题目内容
0.1mol/L的下列溶液:①(NH4)2SO4②NH4Cl③Na2CO3④NaHCO3⑤NH4HSO4⑥NaOH
(1)用离子方程式解释③溶液去除油污的原因: .
(2)六种溶液pH由小到大的顺序是(填编号): .
(3)将⑥和②的溶液按体积比1:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是 .(4)①②⑤三种溶液中由水电离出的c(H+)浓度由大到小的顺序是 (填序号).
(1)用离子方程式解释③溶液去除油污的原因:
(2)六种溶液pH由小到大的顺序是(填编号):
(3)将⑥和②的溶液按体积比1:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)Na2CO3属于强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,碱性条件下促进油污水解;
(2)强酸弱碱盐溶液呈弱酸性、强酸弱碱酸式盐溶液呈强酸性,酸性越强,溶液的pH越小,据此进行解答;
(3)将⑥和②的溶液按体积比1:2混合后,溶液的pH>7,溶液溶质为NaCl和NH4Cl、NH3.H2O,从盐类的水解角度分析;
(4)酸或碱抑制水电离,含有弱根离子的盐促进水电离,铵根离子浓度越大,水解生成的氢离子浓度越大,水的电离程度越大,据此进行判断.
(2)强酸弱碱盐溶液呈弱酸性、强酸弱碱酸式盐溶液呈强酸性,酸性越强,溶液的pH越小,据此进行解答;
(3)将⑥和②的溶液按体积比1:2混合后,溶液的pH>7,溶液溶质为NaCl和NH4Cl、NH3.H2O,从盐类的水解角度分析;
(4)酸或碱抑制水电离,含有弱根离子的盐促进水电离,铵根离子浓度越大,水解生成的氢离子浓度越大,水的电离程度越大,据此进行判断.
解答:
解:(1)Na2CO3溶液中,碳酸根离子水解导致溶液呈碱性,水解的离子方程式为:CO32-+H2O?HCO3-+OH-,碱性条件下促进油污水解,从而达到除油污的目的,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)相同浓度的这几种溶液中,①(NH4)2SO4为强酸弱碱盐,其溶液呈酸性;
②NH4Cl为强酸弱碱盐,其溶液呈弱酸性,但铵根离子水解个数小于硫酸铵,所以酸性小于硫酸铵;
③Na2CO3为强碱弱酸盐,碳酸根离子水解导致溶液呈弱碱性;
④NaHCO3为强碱弱酸酸式盐,碳酸氢根离子水解能力小于碳酸根离子,导致溶液碱性小于碳酸钠;
⑤NH4HSO4为强酸弱碱酸式盐,其溶液呈强酸性;
⑥NaOH为强碱,溶液的pH最大,
所以这几种溶液中pH从小到大的顺序是:⑤<①<②<④<③<⑥,
故答案为:⑤<①<②<④<③<⑥;
(3)将⑥和②的溶液按体积比1:2混合后,溶液溶质为等浓度的NaCl、NH4Cl和一水合氨,由于铵根离子部分水解,则c (Cl-)>c(NH4+);溶液中存在:NH3?H2O?NH4++OH-,且溶液的pH>7,说明一水合氨的电离程度大于铵根离子水解程度,则c(OH-)>c(H+),根据电荷守恒可得:c(NH4+)>c(Na+),所以溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)①(NH4)2SO4为强酸弱碱盐,铵根离子水解,促进了水的电离,且水解生成的氢离子大于②;②NH4Cl为强酸弱碱盐,水解促进水的电离,由于铵根离子浓度小于①,则水解生成的氢离子需要①;⑤NH4HSO4为酸性溶液,抑制了水的电离,其溶液中水的电离程度最小,所以三种溶液中水电离的氢离子浓度大小为:①>②>⑤,
故答案为:①>②>⑤.
故答案为:CO32-+H2O?HCO3-+OH-;
(2)相同浓度的这几种溶液中,①(NH4)2SO4为强酸弱碱盐,其溶液呈酸性;
②NH4Cl为强酸弱碱盐,其溶液呈弱酸性,但铵根离子水解个数小于硫酸铵,所以酸性小于硫酸铵;
③Na2CO3为强碱弱酸盐,碳酸根离子水解导致溶液呈弱碱性;
④NaHCO3为强碱弱酸酸式盐,碳酸氢根离子水解能力小于碳酸根离子,导致溶液碱性小于碳酸钠;
⑤NH4HSO4为强酸弱碱酸式盐,其溶液呈强酸性;
⑥NaOH为强碱,溶液的pH最大,
所以这几种溶液中pH从小到大的顺序是:⑤<①<②<④<③<⑥,
故答案为:⑤<①<②<④<③<⑥;
(3)将⑥和②的溶液按体积比1:2混合后,溶液溶质为等浓度的NaCl、NH4Cl和一水合氨,由于铵根离子部分水解,则c (Cl-)>c(NH4+);溶液中存在:NH3?H2O?NH4++OH-,且溶液的pH>7,说明一水合氨的电离程度大于铵根离子水解程度,则c(OH-)>c(H+),根据电荷守恒可得:c(NH4+)>c(Na+),所以溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)①(NH4)2SO4为强酸弱碱盐,铵根离子水解,促进了水的电离,且水解生成的氢离子大于②;②NH4Cl为强酸弱碱盐,水解促进水的电离,由于铵根离子浓度小于①,则水解生成的氢离子需要①;⑤NH4HSO4为酸性溶液,抑制了水的电离,其溶液中水的电离程度最小,所以三种溶液中水电离的氢离子浓度大小为:①>②>⑤,
故答案为:①>②>⑤.
点评:本题考查了溶液中离子浓度大小比较、盐的水解原理及其应用、溶液酸碱性与溶液pH的关系等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生灵活应用基础知识的能力,注意明确盐的水解原理,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中离子浓度大小.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ |
| C、盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为Ca2++CO32-=CaCO3↓ |
| D、在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,即能使淀粉溶液变蓝2I-+H2O2+2H+=I2+2H2O |
在一个不传热且容积固定的密闭反应器里,有可逆反应:mA(g)+nB(g)?pC(g)+qD(g) 当m、n、p、q为任意正整数时,该反应达到平衡的标志是( )
①体系的压强不再发生变化;
②体系的温度不再发生变化;
③各组分的物质的量浓度不再发生变化;
④各组分的质量分数不再发生变化;
⑤反应速率γA:γB:γC:γD=m:n:p:q;
⑥单位时间内,若消耗了m mol A物质,同时也消耗了qmolD物质.
①体系的压强不再发生变化;
②体系的温度不再发生变化;
③各组分的物质的量浓度不再发生变化;
④各组分的质量分数不再发生变化;
⑤反应速率γA:γB:γC:γD=m:n:p:q;
⑥单位时间内,若消耗了m mol A物质,同时也消耗了qmolD物质.
| A、①③⑤ | B、①④⑥ |
| C、②③④⑥ | D、③④⑤⑥ |
将2mol NaHCO3固体和1.5mol Na2O2固体放到一密闭容器中加热至反应完全,若容器温度仍保持在高温,则下列说法中正确的是( )
| A、容器内的固体物质有NaHCO3和Na2O2 |
| B、容器内的气体物质仅有O2 |
| C、容器内没有NaOH |
| D、容器内的气体物质中含有H2O |
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与盐酸的反应 OH-+H+=H2O |
| B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CO32-+2H+=Ca2++H2O+CO2↑ |
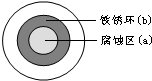 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A、液滴中的Cl-由a区向b区迁移 |
| B、液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- |
| C、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |
| D、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |