题目内容
7.NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 60乙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HO3-和CO32-E离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 同温、同压、同体积的CO和NO含有的质子数 |
分析 A、求出乙醇的物质的量,然后根据1mol乙醇中含8mol共价键来分析;
B、根据物料守恒来分析;
C、求出钠的物质的量,然后根据反应后钠元素为+1价来分析;
D、同温同压同体积的CO和NO的物质的量相等,但CO和NO中含有的质子数分别为14个和15个.
解答 解:A、60g乙醇的物质的量为n=$\frac{60g}{46g/mol}$=1.3mol,而1mol乙醇中含8mol共价键,故1.3mol乙醇中含10.4mol共价键就10.4NA个,故A错误;
B、HCO3-在溶液中既能部分电离为CO32-,又能部分水解为H2CO3,根据物料守恒可知:溶液中的HCO3-、CO32-和H2CO3的和为0.1NA个,故B错误;
C、23g钠的物质的量为1mol,而反应后钠元素为+1价,故1mol钠失去1mol电子即NA个,故C正确;
D、同温同压同体积的CO和NO的物质的量相等,但CO和NO中含有的质子数分别为14个和15个,故等物质的量的CO和NO中的质子数之比为14:15,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4 LH2O含有NA个水分子 | |
| B. | 标准状况下,22.L空气含有NA个单质分子 | |
| C. | 常温常压下,11.2 L氯气所含的原子数目为NA | |
| D. | 标准状况下,1.12 L O2 和1.12 L CO2均含有0.1NA氧原子 |
15.某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )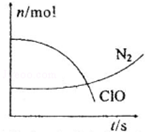

| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
12.下列有关化学反应速率的说法中,正确的是( )
| A. | 100mL 2mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是放热反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的CO和NO可以反应生成N2和CO2,在排气管中加催化剂可减小空气污染 |
19. 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
16.下列有关溶液(室温下)的说法正确的是( )
| A. | Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | 0.1mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 物质的量浓度相等的:①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中c(NH4+)的大小关系:④>①>②>③ | |
| D. | 0.1mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
13. 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:
CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H回答下列问题:
(1)已知键能数值如下:
则△H=+124kJ.mol-1;若乙烷、乙烯的燃烧热分别为1559.8kJ-mol-l、1411kJ-mol-l,则代表H2燃烧热的热化学反应方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-272.8kJ.mol-1.
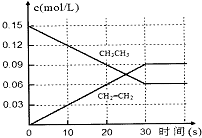
(2)T℃下,在2L的恒容密闭容器中充入一定量的CH3CH3,各物质的浓度随时间变化如图:
①0-30s,v(H2)=0.003mol/(L•s),反应的平衡常数K0.135mol/L.
②升高温度,平衡常数K增大(填“增大”“减小”“不变”),理由是该反应为吸热反应,升高温度,平衡正向移动,K增大
③T℃下,若在2L的恒容密闭容器中充入的是0.6mol CH3CH3,则达平衡后CH3CH3转化率<60%(填“>”“<”“=”),理由是T℃,在2L容器中充入0.3molCH3CH3的转化率为60%,若充入的是0.6molCH3CH3,即相当于在原0.3molCH3CH3的基础上再增加了0.3molCH3CH3,相当于增压,CH3CH3转化率降低.
 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H回答下列问题:
(1)已知键能数值如下:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ.mol-1) | 412 | 348 | 612 | 436 |
(2)T℃下,在2L的恒容密闭容器中充入一定量的CH3CH3,各物质的浓度随时间变化如图:
①0-30s,v(H2)=0.003mol/(L•s),反应的平衡常数K0.135mol/L.
②升高温度,平衡常数K增大(填“增大”“减小”“不变”),理由是该反应为吸热反应,升高温度,平衡正向移动,K增大
③T℃下,若在2L的恒容密闭容器中充入的是0.6mol CH3CH3,则达平衡后CH3CH3转化率<60%(填“>”“<”“=”),理由是T℃,在2L容器中充入0.3molCH3CH3的转化率为60%,若充入的是0.6molCH3CH3,即相当于在原0.3molCH3CH3的基础上再增加了0.3molCH3CH3,相当于增压,CH3CH3转化率降低.
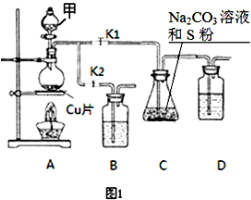 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.