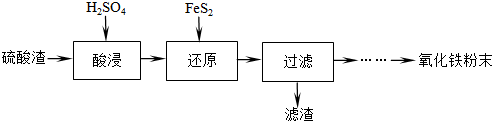
题目内容
明矾石的主要成分是K2SO4?Al2(SO4)3?2Al2O3?6H2O,此外还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:
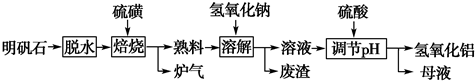
(1)“焙烧”过程中反应的化学方程式为:2Al2(SO4)3+3S═2Al2O3+ .该反应的氧化剂是 .若生成1mol Al2O3,则转移电子数 mol.
(2)熟料“溶解”时反应的离子方程式为 .
(3)检查废渣中含有Fe2O3所需的试剂是 .
(4)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是 .
(5)“母液”中可回收的物质是 、 .
(6)流程中用硫酸调节pH时需精确控制,为什么? .

(1)“焙烧”过程中反应的化学方程式为:2Al2(SO4)3+3S═2Al2O3+
(2)熟料“溶解”时反应的离子方程式为
(3)检查废渣中含有Fe2O3所需的试剂是
(4)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
(5)“母液”中可回收的物质是
(6)流程中用硫酸调节pH时需精确控制,为什么?
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验评价题,元素及其化合物
分析:根据元素守恒和得失电子守恒,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质.
(1)所含元素化合价降低的反应物是氧化剂;根据得失电子守恒计算;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)由工艺流程可知,废渣的主要成分为Fe2O3,废渣中加入盐酸溶解,滴再加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3;
(4)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(5)“母液”中含有硫酸盐;
(6)氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解.
| ||
(1)所含元素化合价降低的反应物是氧化剂;根据得失电子守恒计算;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)由工艺流程可知,废渣的主要成分为Fe2O3,废渣中加入盐酸溶解,滴再加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3;
(4)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(5)“母液”中含有硫酸盐;
(6)氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解.
解答:
解:根据元素守恒和得失电子守恒,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,Al2(SO4)3化合价降低得电子为氧化剂,反应中失电子被氧化的S为3mol,故反应中转移电子数为:3×4=12mol,生成1mol Al2O3,则转移电子数为6mol,
故答案为:9SO2;Al2(SO4)3;6;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)由工艺流程可知,废渣的主要成分为Fe2O3,取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3,故答案为:盐酸、KSCN溶液;
(4)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(5)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,
故答案为:K2SO4;Na2SO4;
(6)氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解,从而得不到氢氧化铝沉淀,故答案为:氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解,从而得不到氢氧化铝沉淀.
| ||
(1)反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S
| ||
故答案为:9SO2;Al2(SO4)3;6;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)由工艺流程可知,废渣的主要成分为Fe2O3,取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3,故答案为:盐酸、KSCN溶液;
(4)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(5)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,
故答案为:K2SO4;Na2SO4;
(6)氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解,从而得不到氢氧化铝沉淀,故答案为:氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解,从而得不到氢氧化铝沉淀.
点评:本题考查物质的制备、分离等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,题目难度中等,注意把握物质的相关性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
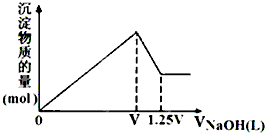 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )| A、1:1 | B、2:3 |
| C、3:1 | D、6:1 |
X、Y、Z、M、W为五种短周期元素.它们在周期表的相对位置如下表:则下列说法正确的是( )
| M | |||||||
| X | Y | Z | |||||
| W |
| A、Y、M形成的气态化合物在标准状况下的密度为0.76 g.L-1 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
已知氢气中1mol H-H断裂时吸收热量为436kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则1mol氢气完全燃烧生成水蒸气时放出热量( )
| A、221 kJ |
| B、557 kJ |
| C、242 kJ |
| D、188 kJ |
下列说法正确的是( )
| A、将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
| B、配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 |
| C、草木灰可以与铵态氮肥混合使用 |
| D、高铁酸钠(Na2FeO4)能应用于饮用水消毒并净化水 |
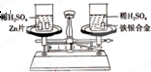 如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )
如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )| A、65:56 | B、56:108 |
| C、56:9 | D、65:9 |