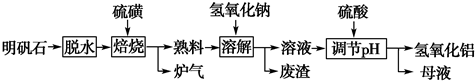
题目内容
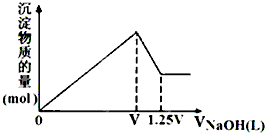 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )| A、1:1 | B、2:3 |
| C、3:1 | D、6:1 |
考点:镁、铝的重要化合物
专题:图示题,几种重要的金属及其化合物
分析:氢氧化铝能和氢氧化钠反应而溶解,氢氧化镁不能溶于氢氧化钠中,则由图象可知,则V~1.25V体积时NaOH发生了NaOH与氢氧化铝的反应,由铝原子守恒可判断原溶液中的铝离子,即得出氯离子的量,再由0~V体积时NaOH发生镁离子、铝离子分别与碱反应生成沉淀,可确定镁离子的量,即得出硫酸根离子的量.
解答:
解:第一条上升的直线是表示AlCl3和MgSO4一起产生沉淀,第二条下降的直线表示Al(OH)3沉淀溶解,
设氢氧化钠溶液的浓度为c,根据Al(OH)3+OH-═AlO2-+2H2O,第二条直线可知加入0.25V体积的NaOH将氢氧化铝完全溶解,可知AlCl3是0.25cVmol,氯离子的量为0.75cVmol,再根据Al3++3OH-═Al(OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠0.75V体积,
再根据第一条直线可知,V-075V=0.25V体积的氢氧化钠将镁离子全部沉淀,
而Mg2++2OH-═Mg(OH)2↓,所以MgSO4为0.125cVmol,所以硫酸根离子的量为0.125cVmol,
所以原溶液中Cl-与SO42-的物质的量之比为0.75cVmol:0.125cVmol=6:1,
故选D.
设氢氧化钠溶液的浓度为c,根据Al(OH)3+OH-═AlO2-+2H2O,第二条直线可知加入0.25V体积的NaOH将氢氧化铝完全溶解,可知AlCl3是0.25cVmol,氯离子的量为0.75cVmol,再根据Al3++3OH-═Al(OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠0.75V体积,
再根据第一条直线可知,V-075V=0.25V体积的氢氧化钠将镁离子全部沉淀,
而Mg2++2OH-═Mg(OH)2↓,所以MgSO4为0.125cVmol,所以硫酸根离子的量为0.125cVmol,
所以原溶液中Cl-与SO42-的物质的量之比为0.75cVmol:0.125cVmol=6:1,
故选D.
点评:本题考查金属镁、铝的化合物的性质、有关混合物反应的计算,题目难度中等,注意氢氧化铝能和强碱反应是解题的关键所在,试题考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列实验操作中正确的是( )
| A、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| B、Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
用标准盐酸溶液滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是( )
| A、取干燥洁净的酸式滴定管立即装入标准盐酸 |
| B、用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 |
| C、往盛有20.00mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 |
| D、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 |
无色透明溶液中能大量共存的离子组是( )
| A、Na+、Al3+、HCO3-、NO3- |
| B、AlO2-、Cl-、Mg2+、K+ |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、Na+、NO3-、ClO-、I- |