题目内容
19.下列说法中正确的是( )| A. | 食用白糖的主要成分是葡萄糖 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | NH3易液化,可作制冷剂 | |
| D. | 地质灾害发生后,防疫人员常用明矾对饮用水进行消毒杀菌 |
分析 A.食用白糖主要成分蔗糖;
B.地沟油的主要成分是油脂,汽油是烃;
C.液氨汽化吸收大量的热;
D.根据明矾在净化水中的作用分析;
解答 解:A.食用白糖主要成分蔗糖,故A错误;
B.对“地沟油”进行分馏得到的是油脂,故B错误;
C.液氨汽化吸收大量的热,氨气可以做制冷剂,故C正确;
D.明矾在净化水中只起到加快固体小颗粒沉降的作用而无杀菌的作用.故D错误;
故选:C.
点评 本题考查了生活中的化学,熟悉蔗糖、地沟油、氨气、明矾性质是解题关键,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
20.给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
| A. | Mg$→_{点燃}^{CO_{2}}$C$→_{△}^{H_{2}SO_{4}(浓)}$SO3 | |
| B. | 0.1mol•L-1HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰水}{→}$Ca(ClO)2(aq) | |
| C. | NaCl饱和溶液$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 淀粉溶液$→_{△}^{稀硫酸}$葡萄糖$→_{△}^{Cu(OH)_{2}悬浊液}$Cu2O |
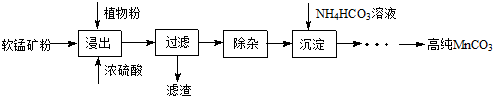
10.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
回答下列问题:
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是4.4-7.5.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是Fe2++H2O2+2H+═Fe3++H2O.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42-聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42-+2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是4.4-7.5.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是Fe2++H2O2+2H+═Fe3++H2O.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42-聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42-+2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
14.实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr $\frac{\underline{\;\;△\;\;}}{\;}$ NaHSO4+HBr↑,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见下表:
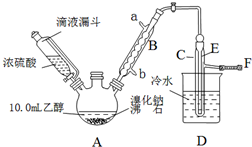
(1)A装置的名称是三颈烧瓶.
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.

| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
11.民以食为天,下列关于厨房调味品的说法正确的是( )
| A. | 食醋和料酒的主要成分都是有机酸 | |
| B. | 食盐和味精的成分中都含有钠离子 | |
| C. | 食用油和人造奶油都是油酸甘油酯 | |
| D. | 蔗糖和小苏打都是可溶于水的电解质 |
8.下列有关实验原理或实验操作正确的是( )


| A. | 用水润湿的 pH 试纸测量某溶液的 pH | |
| B. | 用量筒量取 20 mL 0.5000 mol/LH2SO4溶液于烧杯中,加水 80 mL,配制成 0.1000 mol/LH2SO4溶液 | |
| C. | 实验室用图Ⅰ所示装置制取并收集少量氨气 | |
| D. | 实验室用图Ⅱ所示装置除去Cl2中的少量HCl |
9.下列离子方程式书写正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 以石墨作电极电解氯化铝溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| D. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- |