题目内容
4.氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: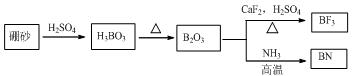
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是B2O3+3CaF2+3H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O、B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(2)基态B原子的电子排布式为1s22s22p1;B和N相比,电负性较大的是N,BN中B元素的化合价为+3;
(3)在BF3分子中,F-B-F的建角是120°,B原子的杂化轨道类型为sp2,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为正四面体;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键(或极性共价键),层间作用力为分子间作用力;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有4个氮原子、4个硼原子,立方氮化硼的密度是$\frac{25×4}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g•cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
分析 (1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,结合原子个数守恒写出方程式;
(2)基态B原子核外有5个电子,根据核外电子排布规律书写电子排布式;依据同周期从左到右电负性依次增强,判断电负性强弱;B第ⅢA族元素,为+3价;
(3)价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定构型和杂化方式;价层电子对互斥理论判断其σ电子对和孤电子对数目;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据其结构与石墨相似,层与层之间应该靠分子间作用力结合.
(5)描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,如图所示: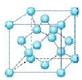 所根据晶胞的结构,利用均摊法可知金刚石晶胞中含有碳原子数为4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞中的质量为$\frac{25g}{{N}_{A}}$,根据ρ=$\frac{m}{V}$计算密度.
所根据晶胞的结构,利用均摊法可知金刚石晶胞中含有碳原子数为4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞中的质量为$\frac{25g}{{N}_{A}}$,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为B2O3+3CaF2+3H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
故答案为:B2O3+3CaF2+3H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(2)硼原子核外电子数目为5,原子的电子排布式为1s22s22p1;同周期从左到右电负性依次增强,所以电负性N>B;B第ⅢA族元素,为+3价;
故答案为:1s22s22p1;N;+3;
(3)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子的中心原子B原子的价层电子对数为;3,属于sp2杂化;BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+$\frac{1}{2}$(3+1-4)=4,该离子中不含孤电子对,为正四面体结构.
故答案为:120°;sp2;正四面体.
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据石墨结构可知六方氮化硼晶体中,层与层之间靠分子间作用力结合,
故答案为:共价键(或极性共价键);分子间作用力;
(5)金刚石晶胞是立方体,晶胞的结构如图所示: 其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,利用均摊法可知金刚石晶胞中含有碳原子数为4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞中的质量为$\frac{25g}{{N}_{A}}$,ρ=$\frac{m}{V}$=$\frac{25×4}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g/cm3,
其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,利用均摊法可知金刚石晶胞中含有碳原子数为4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞中的质量为$\frac{25g}{{N}_{A}}$,ρ=$\frac{m}{V}$=$\frac{25×4}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g/cm3,
故答案为:4;4; $\frac{25×4}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$.
点评 本题考查较为全面,涉及到化学方程式的书写、电子排布式、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) | |
| B. | 向0.1 mol•L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.3 mol•L-1的 HY溶液与0.3 mol•L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1 |
| A. | 食用白糖的主要成分是葡萄糖 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | NH3易液化,可作制冷剂 | |
| D. | 地质灾害发生后,防疫人员常用明矾对饮用水进行消毒杀菌 |
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 54.6 | 0.000 84 | 0.039 |
| A. | 已知MgCO3的Ksp=2.14×10-5 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=2.14×10-5mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将适量的表中的三种物质分别与足量水混合,充分加热、灼烧,最终的固体产物相同 | |
| D. | 用石灰水处理水中的Mg2+和HCO3-,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| C. | 12月2日我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 |
| A. | 冰毒、黄连素 | B. | 海洛因、青霉素 | C. | 大麻、摇头丸 | D. | 胃舒平、鸦片 |
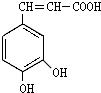 咖啡酸(结构如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(结构如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
. .
.