题目内容
5.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )| A. | 常温下,0.1L 0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA | |
| B. | 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 100g KHCO3和CaCO3的混合物,含有的阳离子数目为NA |
分析 A、铵根离子在溶液中会水解;
B、1mol甲醇燃烧消耗1.5mol氧气,氧气由0价变为-2价;
C、求出丙烷的物质的量,然后根据丙烷中含8条共价键来分析;
D、KHCO3和CaCO3的摩尔质量均为100g/mol,且均含1个阳离子.
解答 解:A、铵根离子在溶液中会水解,故溶液中的铵根离子小于0.01NA个,故A错误;
B、1mol甲醇燃烧消耗1.5mol氧气,氧气由0价变为-2价,故1.5mol氧气转移6mol电子即6NA个,故B正确;
C、标况下22.4L丙烷的物质的量为1mol,而丙烷中含8条共价键,故1mol丙烷中含8NA条共价键,故C错误;
D、KHCO3和CaCO3的摩尔质量均为100g/mol,故100g混合物的物质的量为1mol,而硫酸氢钾固体只含钾离子和硫酸氢根离子,故硫酸氢钾和碳酸钙均含1个阳离子,故1mol混合物中含NA个阳离子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
15.按如图所示装置进行下列不同的操作,其中不正确的是( )
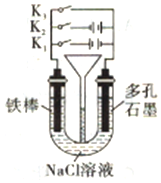

| A. | 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 | |
| B. | 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH- | |
| C. | 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升 | |
| D. | 只闭合K2,U型管左、右两端液面均下降 |
13.有机物甲、乙的结构如右图所示.下列说法错误的是( )
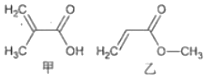

| A. | 甲、乙互为同分异构体 | |
| B. | 甲的一种同分异构体能发生银镜反应 | |
| C. | 甲、乙都能发生取代、加成和水解反应 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
20.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法不正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>Fe3+>稀硫酸 | |
| C. | 向偏铝酸钠溶液通入少量的二氧化碳,生成白色沉淀和碳酸钠,说明HCO3-和AlO2-不能共存 | |
| D. | 在铝制容器中加入食盐溶液,再将变量的银器浸入该溶液中,一段时间后发现黑色会褪去,是因为银器表面Ag2S和金属铝构成原电池而发生了反应 |
10. 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
(1)实验①②表明同周期元素从左往右金属性逐渐减小(填“增大”、“减小”或“不变”).
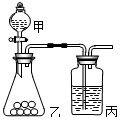
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过),分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
17.下列物质不能通过化合反应得到的是( )
| A. | FeCl2 | B. | Fe(OH)3 | C. | CuO | D. | CuS |
14.检验某无色溶液中是否含有I-,所用试剂不合理的是( )
| A. | 淀粉溶液和氯水 | B. | 硝酸酸化的硝酸银溶液 | ||
| C. | 氯水和四氯化碳 | D. | 溴水和酒精 |
13.200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g.则原混合气体中CO2和H2O的物质的量之比是( )
| A. | 1:4 | B. | 3:11 | C. | 1:11 | D. | 21:22 |