题目内容
19.下列实验可行的是( )| A. | 用酸性高锰酸钾溶液区别乙烷和乙烯 | |
| B. | 用BaCl2除去NaOH 溶液中混有的少量Na2SO4 | |
| C. | 用KSCN溶液检验溶液中含有的Fe2+ | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
分析 A.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烷和酸性高锰酸钾溶液不反应;
B.硫酸钠和氯化钡反应生成硫酸钡沉淀且同时生成硫酸钠杂质;
C.铁离子和KSCN溶液反应生成络合物导致溶液呈血红色,亚铁离子和KSCN溶液不反应;
D.难溶性物质和可溶性物质可以采用溶解过滤方法分离提纯.
解答 解:A.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烷和酸性高锰酸钾溶液不反应,现象不同,所以可以用酸性高锰酸钾溶液鉴别乙烷和乙烯,故A正确;
B.硫酸钠和氯化钡反应生成硫酸钡沉淀且同时生成硫酸钠杂质,应该用适量的氢氧化钡溶液除去硫酸钠,故B错误;
C.铁离子和KSCN溶液反应生成络合物导致溶液呈血红色,亚铁离子和KSCN溶液不反应,亚铁离子可以用铁氰化钾或酸性高锰酸钾溶液检验,故C错误;
D.难溶性物质和可溶性物质可以采用溶解过滤方法分离提纯,二者都易溶于水,所以不能采用溶解、过量方法分离提纯,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质鉴别、除杂、离子检验、物质分离提纯等知识点,明确实验原理、物质性质差异性是解本题关键,侧重考查学生分析与实验能力,知道亚铁离子和铁离子的检验方法及现象,题目难度不大.

练习册系列答案
相关题目
9.利用铜萃取剂M,通过如下反应实现铜离子的富集(如图1):
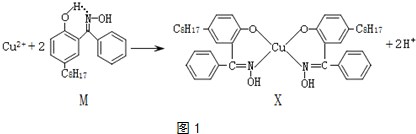
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图2)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
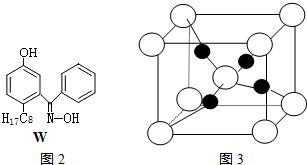
(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表.回答下列问题:
图3是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是4.

(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图2)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.

(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表.回答下列问题:
| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
①该温度是1000℃以上.
②铜原子的配位数是4.
11.下列各组实验中,将等体积的Na2S2O3和HCl混合,反应速率最快的一组是( )
| 组号 | 反应温度(℃) | Na2S2O3浓度(mol/L) | HCl浓度(mol/L) |
| A. | 10 | 0.1 | 0.1 |
| B. | 10 | 0.2 | 0.2 |
| C. | 20 | 0.1 | 0.1 |
| D. | 20 | 0.2 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法中不正确的是( )
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 反应物的总能量高于生成物的总能量时发生放热反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
9.下列对有机物结构或性质的描述,错误的是( )
| A. | 2-甲基丙烷的所有碳原子可能处于同一平面 | |
| B. | 一定条件下,Cl2可在甲苯(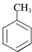 )的苯环或侧链上发生取代反应 )的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯(C3H6)的物质的量各1mol,完全燃烧都是生成3mol H2O | |
| D. | 光照下2,2-二甲基丙烷与Cl2反应其一氯代物只有一种 |
 ;
;
 ;反应类型:加聚反应
;反应类型:加聚反应