题目内容
15.“酸雨”的形成主要是由于是( )| A. | 煤燃烧时产生大量CO2 | B. | 煤不完全燃烧产生大量CO | ||
| C. | 煤燃烧时产生大量SO2 | D. | 工业生产中排放大量烟尘 |
分析 酸雨的形成主要与工业上大量燃烧含硫燃料有关,其次与汽车尾气等原因有关,以此来解答.
解答 解:A.二氧化碳与温室效应有关,溶解二氧化碳的雨水为正常雨水,故A不选;
B.CO为有毒气体,不能与水反应,不能形成酸雨,故B不选;
C.工业上大量燃烧含硫燃料,使空气中二氧化硫的含量增加,为酸雨形成的主要原因,故C选;
D.工业生产中排放大量烟尘,可导致雾霾发生,故D不选;
故选C.
点评 本题考查三废处理及环境保护,为高频考点,把握酸雨的形成、物质的性质为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
5.铝制品具有较强的抗腐蚀性,主要是因为( )
| A. | 铝的化学性质稳定 | |
| B. | 铝在常温时与氧气不反应 | |
| C. | 铝具有金属性,也具有非金属性 | |
| D. | 铝与氧气反应生成一层致密的氧化物薄膜 |
6.下列关于氯离子的表示方法,错误的是( )
| A. | Cl- | B. |  | C. |  | D. |  |
3.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol硫单质在过量氧气中燃烧产生NA个SO3分子 | |
| B. | 标准状况下,22.4LSO3中含有氧原子数为3NA | |
| C. | 标准状况下,18gH2O中含有氧原子数为NA | |
| D. | 5.4g铝单质与足量NaOH溶液反应,转移电子数为0.6NA |
20.常温下,某溶液中c(H+)=1×10-11mol/L,则该溶液的PH是( )
| A. | 3 | B. | 7 | C. | 8 | D. | 11 |
7.Y元素的阳离子和X元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | Y的原子序数比X的大 | B. | Y的离子半径比X的离子大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
4.如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
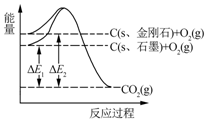

| A. | 1 mol石墨完全转化为金刚石需吸收1.9 kJ热量 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol金刚石和1 mol O2化学键断裂吸收的能量总和大于1 mol CO2分子中化学键断裂吸收的能量 |
5.下列有关乙二酸(HOOC-COOH)的说法中正确的是(设NA为阿伏加德罗常数的值)( )
| A. | 标准状况下90g乙二酸所占的体积约为22.4L | |
| B. | lmol乙二酸中含有共用电子对的数目为9NA | |
| C. | 90g乙二酸被NaC1O氧化生成CO2,转移的电子数为NA | |
| D. | 0.lmol•L-1的乙二酸溶液中,H2C2O4、C2O2-和HC2O4-的微粒数之和为0.1NA |