题目内容
20.常温下,某溶液中c(H+)=1×10-11mol/L,则该溶液的PH是( )| A. | 3 | B. | 7 | C. | 8 | D. | 11 |
分析 根据pH=-lgc(H+)计算.
解答 解:常温下,某溶液中c(H+)=1×10-11mol/L,则pH=-lgc(H+)=-lg(1×10-11)=11;
故选D.
点评 本题考查了pH的有关计算,题目难度不大,注意把握pH的含义以及pH的计算方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
11.柠檬烯是一种常用香料,其结构简式如图.有关柠檬烯的分析正确的是( )


| A. | 它的一氯代物有6种 | |
| B. | 它分子式为:C10H18 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化、加聚等反应 |
8.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色反应呈黄色,五种元素核电荷数之和为54,W、Z最外层电子数相同,Z的核电荷数是W的2倍,工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | X、Y和Z三种元素的最高价氧化物的水化物两两间能反应 | |
| C. | 阳离子的氧化性:X>Y | |
| D. | W的最简单氢化物沸点比Z的高 |
15.“酸雨”的形成主要是由于是( )
| A. | 煤燃烧时产生大量CO2 | B. | 煤不完全燃烧产生大量CO | ||
| C. | 煤燃烧时产生大量SO2 | D. | 工业生产中排放大量烟尘 |
5.下列表述中正确的是( )
| A. | 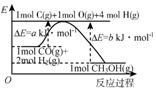 根据图可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH (g)△H=(b-a)kJ•mol-1 | |
| B. |  图表示2molH2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ | |
| C. | 1molNaOH分别和1molCH3COOH、1molHNO3反应,后者比前者△H小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
12.化学与生活密切相关,下列说法正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素 | |
| D. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
9.将一定量的氯气通入50mL 10.00mol•L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、NaClO3共存体系(不考虑氯气和水的反应).下列说法正确的是( )
| A. | 若反应中转移的电子为nmol,则0.25<n<0.5 | |
| B. | 溶液中n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 | |
| C. | 与NaOH反应的氯气物质的量:0.25 mol<n (Cl2)<0.75mol | |
| D. | 当溶液中n(NaClO):n(NaClO3)=5:1时,反应的离子方程式为:8Cl2+16OH-═10Cl-+5ClO-+ClO3-+8H2O |
10.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO═2NaCl+NaClO3.在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
| A. | NaCl、NaClO3 | B. | NaClO3、NaClO4 | C. | NaCl、NaClO | D. | 无法确定 |