题目内容
14.将下列各组物质按酸、碱、盐分类顺次排列,其中正确的是( )| A. | 硫酸 纯碱 孔雀石[Cu2(OH)2CO3] | B. | 硝酸 烧碱 硫酸钡 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
分析 酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物;可以采用排除法(即只要发现选项中有一种不符合酸、碱、盐的排列要求,即可排除该选项)进行快速排除,据此进行分析判断.
解答 解:A、纯碱是碳酸钠,是盐不是碱,故A错误;
B、硝酸是酸;烧碱即NaOH,故为碱;硫酸钡为盐,故B正确;
C、乙醇不能电离出氢氧根,故不是碱,故C错误;
D、盐酸是氯化氢的水溶液,是混合物,故不是酸;苛性钠为NaOH,故不是盐而是碱,故D错误.
故选B.
点评 本题考查了物质类别的判别,抓住酸、碱、盐的特征分析解答,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
4.下表是元素周期表的一部分:
根据a~h各元素的性质,选择相应的化学符号、化学式或化学方程式填空:(不得用a~h字母回答)
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | a | |||||||
| 二 | d | e | h | |||||
| 三 | b | c | f | g |
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.
2.下列仪器不能用酒精灯直接加热的是( )
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶 ⑥蒸发皿 ⑦容量瓶 ⑧表面皿.
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶 ⑥蒸发皿 ⑦容量瓶 ⑧表面皿.
| A. | ①③⑤⑦⑧ | B. | ①③④⑤⑦ | C. | ④⑦⑧ | D. | ②③⑤⑦⑧ |
19.设 NA为阿伏加德罗常数的值.下列说法错误的是( )
| A. | 28 g 由 C2H4 和 C3H6 组成的混合物中含有氢原子的数目为 4 NA | |
| B. | 将 CO2通过 Na2O2,增重 2.8g 时,反应中转移电子数目为 0.1NA | |
| C. | 1 mol[Cu(NH3)4]中含有配位键的数目为 4NA | |
| D. | 标准状况下,11.2 L HF 的分子总数为 0.5NA |
6.下列叙述正确的是( )
| A. | 物质燃烧都是放热反应 | |
| B. | 化学反应总是伴随着能量的变化 | |
| C. | 化学反应中需要加热的反应一定是吸收反应 | |
| D. | 化学反应中放出的热量就是反应热 |
3.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是( )
| A. | 分别取样配成溶液,分别往两份溶液中逐滴滴加几滴稀盐酸,一开始就有气体产生的为NaHCO3 | |
| B. | 分别取样加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,直接观察火焰的颜色 |
4.试回答下列各题:
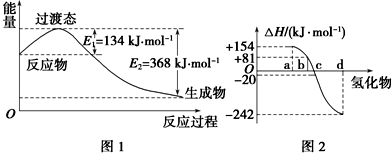
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.

(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.