题目内容
11. 常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )
常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )| A. | 原混合酸中NO3-的物质的量为0.2mol | |
| B. | 原混合酸中H2SO4物质的量浓度为2mol•L-1 | |
| C. | OA段与BC段反应中电子转移的物质的量之比为2:1 | |
| D. | 取20ml原混合酸加水稀释至1L后溶液的pH=1 |
分析 由图象可知,开始生产氢气,中间气体体积不变,后段气体体积增大,故OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑.
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.纵观整个过程,加入22.4gFe时,此时溶液中溶质为硫酸亚铁,根据守恒计算;
C.结合各阶段消耗Fe的质量,根据各阶段反应中Fe元素化合价变化计算转移电子物质的量;
D.根据电荷守恒,可知原溶液中c(H+)=c(NO3-)+2c(SO42-),再根据稀释定律计算.
解答 解:A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以原混合酸中n(NO3-)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,故A正确;
B.反应消耗22.4g铁,也就是$\frac{22.4g}{56g/mol}$=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根离子守恒,所以含硫酸为0.4mol,则c(硫酸)=$\frac{0.4mol}{0.2L}$=2mol/L,故B正确;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,消耗Fe为11.2g,物质的量=$\frac{11.2g}{56g/mol}$=0.2mol,转移电子为0.2mol×3=0.6mol,
BC段发生反应为:Fe+2H+=Fe2++H2↑,消耗Fe为22.4g-16.8g=5.6g,物质的量=$\frac{5.6g}{56g/mol}$=0.1mol,转移电子为0.1mol×2=0.2mol,
故OA段与BC段反应中电子转移的物质的量之比=0.6mol:0.3mol=3:1,故C错误;
D.根据电荷守恒,可知原溶液中c(H+)=c(NO3-)+2c(SO42-)=$\frac{0.2mol}{0.2L}$+2×2mol/L=5mol/L,取20mL原混合酸加水稀释至1L后溶液的中c(H+)=$\frac{0.02L×5mol/L}{1L}$=0.1mol/L,氢离子浓度等于0.1mol/L,即稀释后pH=1,故D正确.
故选C.
点评 本题以图象为载体,考查有关金属和酸反应的计算题,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,侧重于考查学生的分析能力和计算能力.

 名校课堂系列答案
名校课堂系列答案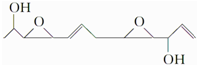 下列关于该化合物的说法正确的是( )
下列关于该化合物的说法正确的是( )| A. | 分子式为C12H19O4 | B. | 是乙醇的同系物 | ||
| C. | 可发生氧化反应 | D. | 处于同一平面的原子最多有5个 |
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶 ⑥蒸发皿 ⑦容量瓶 ⑧表面皿.
| A. | ①③⑤⑦⑧ | B. | ①③④⑤⑦ | C. | ④⑦⑧ | D. | ②③⑤⑦⑧ |
| A. | 28 g 由 C2H4 和 C3H6 组成的混合物中含有氢原子的数目为 4 NA | |
| B. | 将 CO2通过 Na2O2,增重 2.8g 时,反应中转移电子数目为 0.1NA | |
| C. | 1 mol[Cu(NH3)4]中含有配位键的数目为 4NA | |
| D. | 标准状况下,11.2 L HF 的分子总数为 0.5NA |
| A. | 物质燃烧都是放热反应 | |
| B. | 化学反应总是伴随着能量的变化 | |
| C. | 化学反应中需要加热的反应一定是吸收反应 | |
| D. | 化学反应中放出的热量就是反应热 |
| A. | 分别取样配成溶液,分别往两份溶液中逐滴滴加几滴稀盐酸,一开始就有气体产生的为NaHCO3 | |
| B. | 分别取样加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,直接观察火焰的颜色 |