题目内容
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.50mol?L-1 H2SO4、2mol?L-1 H2SO4、18.4mol?L-1 H2SO4
实验一:甲组同学研究的实验报告如下表:
(2)甲组同学的实验目的是 ;根据控制变量法,要得出正确的实验结论,还需要控制的实验条件是 .
实验二:乙组同学为了研究不同浓度的硫酸对反应速率的影响,设计了以下实验:
 (3)用此装置进行定量实验,应选用上述的实验药品是: ;
(3)用此装置进行定量实验,应选用上述的实验药品是: ;
(4)乙组同学应该测定的实验数据是 :
(5)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的): .
实验一:甲组同学研究的实验报告如下表:
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别取等体积的2mol.L-1 H2SO4 于试管中 ②分别投入大小、形状相同的 Cu、Fe、 Mg. |
镁反应速率比铁快, 铜不反应 |
(1) |
实验二:乙组同学为了研究不同浓度的硫酸对反应速率的影响,设计了以下实验:
 (3)用此装置进行定量实验,应选用上述的实验药品是:
(3)用此装置进行定量实验,应选用上述的实验药品是:(4)乙组同学应该测定的实验数据是
(5)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):
考点:化学反应速率的影响因素
专题:
分析:(1)金属活泼性不同,反应速率不同;
(2)甲组实验中,金属不同,酸相同;控制变量法要求温度等外因相同;
(3)由实验探究不同浓度的硫酸对反应速率的影响可知,则选相同金属,不同浓度酸即可;
(4)乙组同学应该测定时间及气体的体积;
(5)此实验忽视了温度应相同.
(2)甲组实验中,金属不同,酸相同;控制变量法要求温度等外因相同;
(3)由实验探究不同浓度的硫酸对反应速率的影响可知,则选相同金属,不同浓度酸即可;
(4)乙组同学应该测定时间及气体的体积;
(5)此实验忽视了温度应相同.
解答:
解:(1)由实验现象可知,镁反应速率比铁快,铜不反应,则金属活泼性不同,反应速率不同,结论为金属性越强化学反应速率越快,
故答案为:金属性越强化学反应速率越快;
(2)甲组实验中,金属不同,酸相同,则该实验研究物质性质对化学反应速率的影响;控制变量法要求温度等外因相同,
故答案为:研究物质性质对化学反应速率的影响;温度相同;
(3)由实验探究不同浓度的硫酸对反应速率的影响可知,则选相同金属,不同浓度酸即可,则选给定的金属镁或铁和不同浓度的酸反应,来确定酸的浓度对反应速率的影响,因浓硫酸具有强氧化性,常温下能和金属铁之间发生钝化,和金属镁反应生成的是二氧化硫,而不是氢气,所以试剂为镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4,
故答案为:镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4;
(4)乙组同学应该测定时间及气体的体积,从而计算反应速率,则实验数据是测一定时间内产生气体的体积,故答案为:测一定时间内产生气体的体积;
(5)因温度影响反应速率,则此实验忽视了温度应相同,故答案为:温度对反应速率的影响.
故答案为:金属性越强化学反应速率越快;
(2)甲组实验中,金属不同,酸相同,则该实验研究物质性质对化学反应速率的影响;控制变量法要求温度等外因相同,
故答案为:研究物质性质对化学反应速率的影响;温度相同;
(3)由实验探究不同浓度的硫酸对反应速率的影响可知,则选相同金属,不同浓度酸即可,则选给定的金属镁或铁和不同浓度的酸反应,来确定酸的浓度对反应速率的影响,因浓硫酸具有强氧化性,常温下能和金属铁之间发生钝化,和金属镁反应生成的是二氧化硫,而不是氢气,所以试剂为镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4,
故答案为:镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4;
(4)乙组同学应该测定时间及气体的体积,从而计算反应速率,则实验数据是测一定时间内产生气体的体积,故答案为:测一定时间内产生气体的体积;
(5)因温度影响反应速率,则此实验忽视了温度应相同,故答案为:温度对反应速率的影响.
点评:本题考查化学反应速率的影响及探究,侧重实验探究能力和分析能力的考查,注意物质本性为确定反应速率的内因,把握外因对反应速率影响及控制变量法分析实验方案,题目难度中等.

练习册系列答案
相关题目
下列离子方程式中正确的是( )
| A、碳酸钡和稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ |
| C、将CO2气体通入澄清石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH+H++SO42-═BaSO4↓+H2O |
 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:
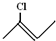 表示的分子式
表示的分子式 的键线式的表达式
的键线式的表达式 有的官能团的名称分别为
有的官能团的名称分别为
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
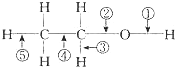 在乙醇的化学性质中,各反应的断键方式可概括如下:
在乙醇的化学性质中,各反应的断键方式可概括如下: