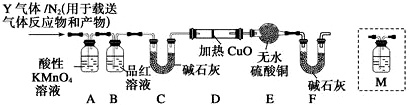
题目内容
8. (1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,
(1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,结构式是
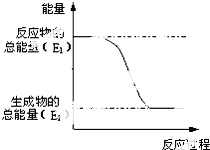
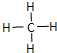 .一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.(2)下列4个反应中,符合示意图描述的反应的是abc.
a.盐酸与NaOH反应 b.Na与H2O反应生成H2
c.铝和盐酸反应 d.灼热的碳与CO2反应.
分析 (1)天然气的其主要成分为甲烷,化学式CH4;根据原子的最外层电子数来分析原子的成键情况,然后写出结构式;根据图可知反应物的总能量大于生成物的总能量;由于反应物所具有的总能量高于生成的总能量来分析;
(2)示意图中为防热反应,而常见的防热反应为:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:(1))天然气的其主要成分为甲烷,化学式CH4,CH4中C原子最外层有4个电子,应成4对共用电子对,H原子最外层有H个电子,应成1对共用电子对,故CH4分子中C原子与H原子之间形成4对共用电子对,结构式为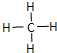 ,由图可知反应物的总能量大于生成物的总能量,由反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,为放热反应,
,由图可知反应物的总能量大于生成物的总能量,由反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,为放热反应,
故答案为:CH4;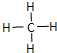 ;>;放出;
;>;放出;
(2)a.盐酸与NaOH反应为酸碱中和反应,故为放热反应,故a正确;
b.Na与H2O反应生成H2,是金属和水或酸的反应,故为放热反应,故b正确;
c.铝和盐酸反应是金属和酸的反应,故为放热反应,故c正确;
d.灼热的碳与CO2反应为以碳为还原剂的氧化还原反应,故为吸热反应,故d错误.
故选abc.
点评 本题主要考查了甲烷的分子式、结构式、化学反应中能量变化,难度不大,注意基础的积累.

练习册系列答案
相关题目
6.等电子体之间往往具有相似的结构,N2O 与 CO2分子具有相似的结构(包括电子式);已知 N2O 分子中氧原子只与一个氮原子相连,下列说法合理的是( )
| A. | N2O 与 CO2均不含非极性键 | |
| B. | N2O 的电子式可 | |
| C. | N2O 为三角形分子 | |
| D. | N2O 与 SiO2互为等电子体,具有相似的结构和相似性质 |
3. 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )| A. | t1℃时,N比M的溶解度大 | |
| B. | 温度从t1℃升高到t3℃时,N的饱和溶液张溶质的质量分数将增大 | |
| C. | M比N的溶解度大 | |
| D. | N中含有少量M时,可用降温结晶法提纯N |
20.短周期主族元素R、A、B、C的原子序数依次增大.R、A原子的最外层电子数之和等于B、C原子的最外层电子数之和,C原子的最内层电子数和次外层电子数之和等于最外层电子数的两倍,B在周期表中主族序数等于最内层电子数的2倍.常温常压下BR4呈气态.下列说法中正确的是( )
| A. | 简单氢化物的稳定性:R>B>C | |
| B. | R分别与A、B、C均组成共价化合物 | |
| C. | 单质的沸点:R>B>A>C | |
| D. | 最高价氧化物对应的水化物的酸性:C>B |

 、2Fe+3Br2=2FeBr3;写出B的试管中还发生的反应化学方程式HBr+AgNO3=AgBr↓+HNO3
、2Fe+3Br2=2FeBr3;写出B的试管中还发生的反应化学方程式HBr+AgNO3=AgBr↓+HNO3 .
.