题目内容
18.氧元素与氟元素能形成OF2分子,该分子的空间构型为V形.分析 该分子中中心原子是O原子,O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型.
解答 解:该分子中中心原子是O原子,O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4且含有2个孤电子对,根据价层电子对互斥理论知该分子空间构型为V形,故答案为:V形.
点评 本题考查分子空间构型判断,为高频考点,明确价层电子对互斥理论内涵是解本题关键,难点是孤电子对计算方法,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
9.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )


| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
6.用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.工艺流程如图:

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O;
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).
13.下列有关氧元素及其化合物的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | Ga的原子结构简图 | |
| C. | 水分子的电子式: | |
| D. | 乙酸甲酯的结构简式:HCOOC2H5 |
7.下列说法不正确的是( )
| A. | 因为水果中一般含有各种芳香族有机酸,食用时能感到较强的酸味,刺激食欲 | |
| B. | 猪肉因含有 而有香味,该物质属于烃的衍生物,能发生加聚反应 而有香味,该物质属于烃的衍生物,能发生加聚反应 | |
| C. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| D. | 在分子筛固体酸作催化剂的条件下,用苯和丙烯反应制备异丙苯,符合绿色化学工艺 |
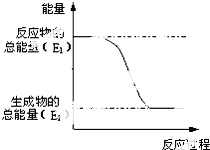 (1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,
(1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,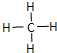 .一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.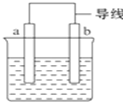 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: