题目内容
6.用NA表示阿伏加德罗常数的值,下列说法错误的是( )| A. | 在标准状况下22.4L H2中含有氢分子的个数为2NA | |
| B. | 56g Fe与稀盐酸充分反应时失去的电子数为2NA | |
| C. | 44g CO2中含有氧原子的个数为2NA | |
| D. | 1L 1mol/L NaCl溶液中含有钠离子的个数为NA |
分析 A、分子个数N=$\frac{V}{Vm}{N}_{A}$;
B、求出铁的物质的量,然后根据铁与盐酸反应后变为+2价来分析;
C、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol氧原子来分析;
D、求出氯化钠的物质的量,然后根据1mol氯化钠中含1mol钠离子来分析;
解答 解:A、分子个数N=$\frac{V}{Vm}{N}_{A}$=$\frac{22.4L}{22.4L/mol}{N}_{A}/mol$=NA个,故A错误;
B、56g铁的物质的量为1mol,而铁与盐酸反应后变为+2价,故1mol铁失去2mol电子即2NA个,故B正确;
C、44g二氧化碳的物质的量为1mol,而1mol二氧化碳中含2mol氧原子,即含2NA个,故C正确;
D、溶液中氯化钠的物质的量n=CV=1mol/L×1L=1mol,而1mol氯化钠中含1mol钠离子,即含NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
1.用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
| A. | 砷原子结构示意图 | |
| B. | 水分子的电子式 | |
| C. |  酸碱中和滴定 | |
| D. |  生产原料甲醛与氨的 物质的量之比为3:2 |
18.下列有关实验操作和现象描述的对应关系正确的是( )
| A. | 向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失 | |
| B. | 向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状沉淀 | |
| C. | 钠与氧气在加热条件下反应,生成白色固体 | |
| D. | 将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来 |
5.室温下,某溶液中由水电离出来的H+和OH-物质的量浓度的乘积为10-24,在该溶液中,一定不能大量存在的离子是( )
| A. | SO32- | B. | HCO3- | C. | NH4+ | D. | NO3- |
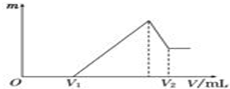 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: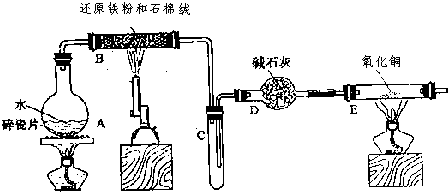
 如图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成.请你用中学化学常见试剂设计一个实验.通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论.试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处.
如图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成.请你用中学化学常见试剂设计一个实验.通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论.试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处.