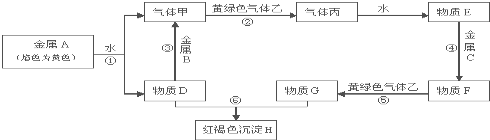
题目内容
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 19g H3O+共用的电子对数为2NA | |
| B. | 常温下,1L0.1mol/L AlCl3溶液中阳离子数小于0.1NA | |
| C. | 标准状况下,1.4gN2和CO的混合气体中含有的电子数为0.7NA | |
| D. | 200mL2.5mol/L乙醇溶液中含有的分子总数为0.5NA |
分析 A、求出H3O+的物质的量,然后根据1molH3O+中含3mol共用电子对来分析;
B、铝离子在溶液中会水解,导致阳离子个数增多;
C、氮气和CO的摩尔质量均为28g/mol,且均含14个电子;
D、乙醇溶液中,除了含乙醇分子外,还含水分子.
解答 解:A、19gH3O+的物质的量为1mol,而1molH3O+中含3mol共用电子对,故含3NA对共用电子对,故A错误;
B、铝离子在溶液中会水解,导致阳离子个数增多,故溶液中的阳离子的个数多于0.1NA个,故B错误;
C、氮气和CO的摩尔质量均为28g/mol,故1.4g混合物的物质的量为0.05moil,且两者均含14个电子,故0.05mol混合物中含0.7NA个电子,故C正确;
D、乙醇溶液中,除了含乙醇分子外,还含水分子,故溶液中的分子个数多于0.5NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
9.设NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | NA个氮气分子与3NA个氢气分子恰好生成2NA个氨气分子 | |
| B. | 在1L0.1mol/L的AICI3溶液中含有0.1NA个AI3+ | |
| C. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| D. | 5.6g的铁与足量的稀硝酸反应转移的电子数是0.3NA |
7.金属M与AgNO3溶液反应的化学方程式为M+2AgNO3=M(NO3)2+2Ag.若M是铜,则下列说法错误的是( )
| A. | M的金属活动性比Ag强 | B. | 反应后溶液的质量增加 | ||
| C. | 金属M不可能变换成铝 | D. | 固体物质的质量增加了 |
3.某同学进行中和反应实验:取适量的NaOH溶液于烧杯中,滴加几滴紫色石蕊试液.再逐渐滴加稀H2SO4测得溶液的pH及颜色变化情况如表:
(1)图中符合上述实验过程的图形是C
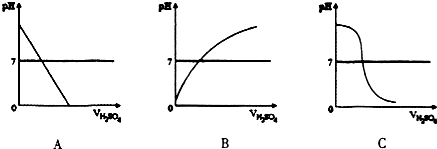
(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
| 滴加稀H2SO4的体积ml | O | l | 2 | 3 | 4 | 5 | 6 | 7 |
| pH | 13.0 | 12.8 | 12.5 | 12.2 | 7.0 | 2.0 | 1.7 | 1.6 |
| 溶液颜色 | 蓝色 | 紫色 | 红色 | |||||

(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
10.甲能发生银镜反应,能与钠反应放出H2,甲经催化加氢还原成乙.乙能与乙酸发生酯化反应,生成的酯的相对分子质量比乙的相对分子质量增大了84,据此推断乙可能是( )
| A. | HOCH2CHO | B. | HOCH2CH2OH | C. | HOCH2COOH | D. | CH3CH(OH)CH(OH)CH3 |
8. 已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
 已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )| A. | 1 g CH3OH(g)完全燃烧放出192.9 kJ的热量 | |
| B. | 1 mol CH3OH(l)完全燃烧放出的热量大于192.9 kJ | |
| C. | 图中甲为CH3OH(g)+$\frac{1}{2}$O2(g),乙为CO2(g)+2H2(g) | |
| D. | CH3OH转变成H2的过程需要吸收能量 |