题目内容
6.下列物质的转化中,浓HNO3既表现了氧化性,又表现了酸性的是( )| A. | Cu→Cu(NO3)2 | B. | C→CO2 | C. | CuO→Cu(NO3)2 | D. | Fe2O3→Fe(NO3)3 |
分析 硝酸表现氧化性,则反应后N元素的化合价降低;表现出酸性,反应物中有硝酸盐生成.
解答 解:A、浓硝酸与铜反应生成硝酸铜、NO2和水,N元素化合价降低,硝酸表现出氧化性,生成硝酸铜,硝酸还表现出酸性,故A正确;
B、浓硝酸与灼热的碳反应生成二氧化碳、二氧化氮和水,硝酸只表现出强氧化性,故B错误;
C、浓硝酸与氧化铜反应反应生成硝酸铜和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故C错误;
D、浓硝酸与Fe2O3反应反应生成硝酸铁和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故D错误;
故选A.
点评 本题考查硝酸的性质,难度中等.要注意硝酸酸性与氧化性的判断方法.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
16.在较高温度下的某溶液中,硝酸钾、氯化钠均达饱和,冷却析出晶体的成分是( )
| A. | 纯硝酸钾晶体 | B. | 大量硝酸钾晶体,少量氯化钠 | ||
| C. | 等量的硝酸钾和氯化钠 | D. | 大量氯化钠,少量硝酸钾 |
17.下列说法不正确的是( )
| A. | 使用催化剂,可以加快反应速率 | |
| B. | 可逆反应A(g)?B(g)+C(g),增大压强正反应速率和逆反应速率增大 | |
| C. | 对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大 | |
| D. | 参加反应物质的性质是决定化学反应速率的主要因素 |
14.对复杂的有机物结构可用“键线式”表示.如苯丙烯酸1-丙烯酯: 可简化为
可简化为 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
 可简化为
可简化为 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A. | 均能发生银镜反应 | B. | 遇FeCl3溶液均显紫色 | ||
| C. | 均能与NaHCO3溶液发生反应 | D. | 均能与浓溴水发生反应 |
1.用一种试剂能鉴别苯酚、戊烯、己烷、乙醇四种溶液,这种试剂是( )
| A. | FeCl3溶液 | B. | 石蕊试液 | C. | 溴水 | D. | KMnO4溶液 |
11.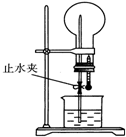 如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )
如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )
 如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )
如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )| A. | Cl2(饱和食盐水) 无色喷泉 | B. | NH3(H2O含石蕊) 蓝色喷泉 | ||
| C. | HCl(H2O含石蕊) 红色喷泉 | D. | SO2(NaOH溶液) 无色喷泉 |
18.下列变化不属于取代反应的是( )
| A. | CH3COOC2H5+H2O$\stackrel{{H}^{+}}{→}$CH3COOH+C2H5OH | |
| B. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3CH3 | |
| C. |  | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
15.某元素R的核外电子数等于核内中子数,取该元素的单质5.60g与氧气充分反应,可以得到12.0g化合物RO2,则元素R在元素周期表中的位置是( )
| A. | 第二周期 IVA族 | B. | 第三周期 IV A族 | C. | 第三周期 VI A族 | D. | 第二周期VI A族 |
16.2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele).有一种有机物的键线式也酷似牛形(如图所示),故称为牛式二烯炔醇.下列有关说法正确的是( )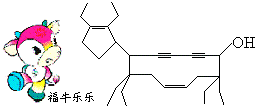

| A. | 牛式二烯炔醇含有4种官能团 | |
| B. | 牛式二烯炔醇不能使酸性KMnO4溶液褪色 | |
| C. | 1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应 | |
| D. | 该有机物的化学式为C29H44O |