题目内容
18.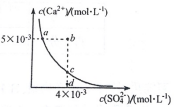 常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )| A. | b 点可能有沉淀生成 | |
| B. | a 点对应的Ksp 等于c 点对应的Ksp | |
| C. | 在d 点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| D. | CaSO4 溶解在水中,一定有c(Ca2+)=c(SO42-)=3×10-3mol•L-1 |
分析 该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,由图象可知,随着c(SO42-)增大,c(Ca2+)减小,达到平衡时,Ksp=c(Ca2+)×c(SO42-)为定值,以此解答该题.
解答 解:A.b点c(Ca2+)较大,c(Ca2+)×c(SO42-)>Ksp,一定有沉淀生成,故A正确;
B.Ksp只与温度有关系,a、c两点的温度相同,所以a点对应的Ksp等于c点对应的Ksp,故B正确;
C.在d点溶液中加入一定量的CaCl2,当溶液中Qc=c(Ca2+)×c(SO42-)>Ksp时会析出沉淀,所以可能会有沉淀析出,故C正确;
D.如完全溶解,且为不饱和溶液,则c(Ca2+)=c(SO42-)<3×10-3mol•L-1,故D错误.
故选D.
点评 本题考查了沉淀溶解平衡的应用、图象分析应用、溶度积计算等,为高考常见题型,答题关键是计算混合溶液中钙离子浓度和硫酸根离子浓度,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
9.关于下列各图的叙述不正确的是( )
| A. | 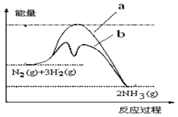 图中曲线b表示工业合成氨中加入铁触媒(催化剂)的能量变化曲线 | |
| B. | 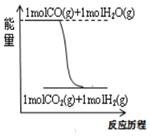 根据图可知在该条件下:CO2(g)+H2(g)═CO(g)+H2O(g)△H<0 | |
| C. |  图中曲线表示向1.0 mol•L-1的醋酸溶液中通入氨气,溶液导电能力的变化情况 | |
| D. |  图中曲线表示常温下向弱酸HA的稀溶液中加水稀释时,c(HA)/c(A-)的变化情况 |
6.下列物质的俗名与化学式相对应的是( )
| A. | 生石灰-Ca(OH)2 | B. | 石膏-Na2SO4•10H2O | ||
| C. | 水玻璃-Na2SiO3水溶液 | D. | 纯碱-NaOH |
13.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.错误的是( )
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的最高价氧化物对应的水化物是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的强 |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO3- | |
| C. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
10.“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请回答下列问题:
Ⅰ、石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成CaO•3MgO•4SiO2.
Ⅱ、某稻壳灰的成分为:
通过如图流程可由稻壳灰制备较纯净的二氧化硅.
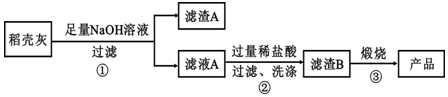
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有3类.
(2)步骤①中涉及SiO2的离子反应方程式为SiO2+2OH-=SiO32-+H2O.
(3)滤渣A的成分有C和Fe2O3(填化学式)
(4)步骤②洗涤沉淀的方法是:往漏斗里的沉淀中注入蒸馏水致水浸没沉淀,让水自然流下,重复2-3次
(5)步骤③反应的化学方程式为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O;实验室进行步骤③用到的仪器有坩埚、泥三角、酒精灯、坩埚钳和三角架.
Ⅰ、石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成CaO•3MgO•4SiO2.
Ⅱ、某稻壳灰的成分为:
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有3类.
(2)步骤①中涉及SiO2的离子反应方程式为SiO2+2OH-=SiO32-+H2O.
(3)滤渣A的成分有C和Fe2O3(填化学式)
(4)步骤②洗涤沉淀的方法是:往漏斗里的沉淀中注入蒸馏水致水浸没沉淀,让水自然流下,重复2-3次
(5)步骤③反应的化学方程式为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O;实验室进行步骤③用到的仪器有坩埚、泥三角、酒精灯、坩埚钳和三角架.
7.氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.已知AlN可与NaOH溶液反应放出有刺激性气味的气体.下列叙述正确的是( )
| A. | AlN中氮元素的化合价为+3 | |
| B. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| C. | 上述反应中,每生成1molAlN需转移6mol电子 | |
| D. | AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑ |
8.下列离子方程式书写正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |