题目内容
下列化学用语不正确的是( )
A、二氧化碳的电子式: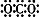 | ||
B、S2-的粒子结构示意图: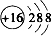 | ||
C、甲烷分子的结构式: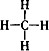 | ||
D、R2+离子核外有a个电子,b个中子,R原子克表示为
|
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.二氧化碳分子中存在两个碳氧双键,不存在碳氧单键;
B.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
C.甲烷分子中存在4个碳氢键,为正四面体结构;
D.R2+离子核外有a个电子,则核电荷数为a+2,质量数为a+b+2,元素符号的左上角表示质量数、左下角表示质子数.
B.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
C.甲烷分子中存在4个碳氢键,为正四面体结构;
D.R2+离子核外有a个电子,则核电荷数为a+2,质量数为a+b+2,元素符号的左上角表示质量数、左下角表示质子数.
解答:
解:A.二氧化碳为共价化合物,分子中存在两个碳氧双键,碳原子和氧原子的最外层都达到8电子稳定结构,二氧化碳正确的电子式为: ,故A错误;
,故A错误;
B.S2-的粒子的核电荷数为16,最外层达到8电子稳定结构,其离子结构示意图为: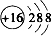 ,故B正确;
,故B正确;
C.甲烷分子为正四面体结构,分子中存在4个碳氢键,甲烷的结构式为: ,故C正确;
,故C正确;
D.R2+离子核外有a个电子,则核电荷数为a+2,含有b个中子的该原子的质量数为a+b+2,该原子可以表示为:
R,故D正确;
故选A.
 ,故A错误;
,故A错误;B.S2-的粒子的核电荷数为16,最外层达到8电子稳定结构,其离子结构示意图为:
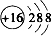 ,故B正确;
,故B正确;C.甲烷分子为正四面体结构,分子中存在4个碳氢键,甲烷的结构式为:
 ,故C正确;
,故C正确;D.R2+离子核外有a个电子,则核电荷数为a+2,含有b个中子的该原子的质量数为a+b+2,该原子可以表示为:
a+b+2 a+2 |
故选A.
点评:本题考查了常见化学用语的判断,题目难度中等,注意掌握结构式、离子结构示意图、元素符号、电子式的概念及正确的表示方法,明确离子化合物与共价化合物的电子式的区别,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
 如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )| A、原子半径:Z<W<Y<X |
| B、元素Y的氧化物能与NaOH溶液反应 |
| C、最简单气态氢化物的热稳定性:Y<X |
| D、W、Z的氧化物都能与碱反应生成盐和水 |
根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
| A、两者都为s-s σ键 |
| B、两者都为p-p σ键 |
| C、前者为p-p σ键,后者为s-p σ键 |
| D、前者为s-s σ键,后者为s-p σ键 |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mol/L FeCl3 溶液中含有3NA个Cl- |
| B、常温常压下,22.4L的NO2和CO2合气体含有2NA个O原子 |
| C、标准状况下,2.24L CCl4含有分子的数目为0.1NA |
| D、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
将质量为m g的CO和质量为m g的H2各自在足量的氧气中燃烧,完全反应后分别将所得的产物全部通过足量的Na2O2固体,待固体充分吸收后,固体的质量将发生改变,则下列判断合理的是( )
| A、固体的质量均减小,减小的质量恰好相同 |
| B、固体的质量均保持不变 |
| C、固体的质量均增大,且均增重m g |
| D、固体的质量均增大,但增加的质量不一样 |
用一质量为1.2g的铝片与45mL 4mol/L稀硫酸反应制取H2,若要增大反应速率,采取的措施:①再加入20mL 4mol/L硫酸;②改用30mL 6mol/L的稀硫酸;③改用20mL 18mol/L浓硫酸;④改用1.2g铝粉代替1.2g铝片;⑤适当升高温度;⑥在敞口容器中反应.其中正确的是( )
| A、①②③④ | B、②④⑤ |
| C、②③④⑤ | D、②④⑤⑥ |
某溶质在某温度时溶解度为S g,其饱和溶液的密度为ρg?cm-3.假设该溶质的摩尔质量为m g?mol-1,则该温度下该饱和溶液的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
除去某溶液里溶解的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A、NaCl(BaCl2):加过量Na2CO3溶液,过滤,再加足量盐酸再蒸发结晶 |
| B、CaO(CaCO3):高温加热 |
| C、NaCl溶液(Br2):加CCl4,分液 |
| D、NaCl溶液(KNO3):加热蒸发得浓溶液后,降温,过滤 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、11gT2O含有的中子数为6NA |
| B、1molNa2O2与CO2完全反应转移的电子数为2NA |
| C、常温下,0.2L0.5mol/LNH4NO3溶液的氮原子数小于0.2NA |
| D、标准状况下,2.24LH2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |