题目内容
根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
| A、两者都为s-s σ键 |
| B、两者都为p-p σ键 |
| C、前者为p-p σ键,后者为s-p σ键 |
| D、前者为s-s σ键,后者为s-p σ键 |
考点:共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:H原子核外电子排布为1s1,F原子核外电子排布为1s22s22p5,形成共价键时,F为2p电子,H为1s电子,以此解答该题.
解答:
解:H原子核外电子排布为1s1,F原子核外电子排布为1s22s22p5,形成共价键时,F为2p电子,H为1s电子,则F2分子中形成的共价键为p-p σ键,HF分子中形成的共价键为s-p σ键,
故选C.
故选C.
点评:本题主要考查了共价键的形成方式,为高频考点,侧重于学生的分析能力的考查,掌握原子的结构与轨道是解题的关键,难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
下列物质中,属于氧化物的是( )
| A、O2 |
| B、Na2O |
| C、H2SO4 |
| D、NaOH |
下列说法正确的是( )
| A、硫酸和磷酸(H3PO4)的摩尔质量不相等 |
| B、18 g水中含有1 mol水分子 |
| C、O2的摩尔质量等于其相对分子质量 |
| D、1mol CO的质量是28 g?mol-1 |
下列说法是某同学在学完专题2后的总结,其中你认为正确的是( )
| A、当正、逆反应的速率同时改变,则平衡一定会发生移动 |
| B、只要能加快正反应速率,一定能使化学平衡向正反应方向移动 |
| C、对于有颜色的平衡体系,当颜色发生变化则平衡一定发生移动 |
| D、温度的改变对任一化学反应体系的反应速率与平衡一定都有影响 |
学家在研究化学物质的时候,常常对物质进行分类,以便对同类物质的组成和性能进行深入研究.下列4组物质:
①Mg O2 N2 NO ②NaOH HCl CH4 KCl
③H2CO3 H2SO4 NaOH HNO3 ④CaO SO2 CO2 SiO2
从物质的分类看,每组中都有一种与其他物质不属于同一类,这4种物质分别是( )
①Mg O2 N2 NO ②NaOH HCl CH4 KCl
③H2CO3 H2SO4 NaOH HNO3 ④CaO SO2 CO2 SiO2
从物质的分类看,每组中都有一种与其他物质不属于同一类,这4种物质分别是( )
| A、Mg HCl H2CO3 CaO |
| B、O2 NaOH H2SO4 SO2 |
| C、NO CH4 NaOH CaO |
| D、NO KCl HNO3 SO2 |
下列说法正确的是( )
| A、含有相同氧原子数的SO2和CO的质量相等 |
| B、等物质的量浓度的稀硫酸溶液与盐酸中的H+浓度相等 |
| C、等温等压下,2mol N2和1mol CO的密度相等 |
| D、100mL 2mol/L的NaOH溶液取出50mL,剩余溶液浓度为1mol/L |
下列化学用语不正确的是( )
A、二氧化碳的电子式: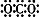 | ||
B、S2-的粒子结构示意图: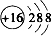 | ||
C、甲烷分子的结构式: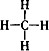 | ||
D、R2+离子核外有a个电子,b个中子,R原子克表示为
|
可逆反应3A(g)?3B+C;△H>0,随着温度的升高,气体的平均相对分子质量有变小的趋势.下列关于B、C两种物质的聚集状态的判断不正确的是( )
| A、B和C可能都是气体 |
| B、B和C一定都是气体 |
| C、若C为固体,则B一定是气体 |
| D、不可能B为固体,C为气体 |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: