题目内容
15.能与Fe3+反应,且能证明Fe3+具有氧化性的是( )①SCN-;②Fe;③Fe2+;④Cu;⑤I-;⑥OH-;⑦Cl2.
| A. | ①②④ | B. | ②④⑤ | C. | ①③⑥ | D. | ②⑤⑦ |
分析 铁离子具有氧化性,与还原剂反应,Fe3+的化合价降低,作氧化剂,表现氧化性,以此来解答.
解答 解:①KSCN与Fe3+结合生成络离子,用于离子检验,不能证明离子的氧化性,故不选;
②Fe与Fe3+发生氧化还原反应,Fe3+的化合价降低,作氧化剂,表现氧化性,故选;
③Fe2+与Fe3+不反应,故不选;
④Cu与Fe3+发生氧化还原反应,Fe3+的化合价降低,作氧化剂,表现氧化性,故选;
⑤I-与Fe3+发生氧化还原反应,Fe3+的化合价降低,作氧化剂,表现氧化性,故选;
⑥OH-与Fe3+发生复分解反应生成红褐色沉淀,用于离子检验,不能证明离子的氧化性,故不选;
⑦Cl2与Fe3+不反应,故不选;
故选B.
点评 本题考查氧化还原反应及离子检验,把握离子之间的反应及现象、氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意离子的性质,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
5.25℃时,浓度均为 0.1mol•L-1 的 HA 溶液和 BOH 溶液,pH 分别是 1 和 11.下列说法正确的是( )
| A. | BOH 溶于水,其电离方程式是 BOH═B++OH- | |
| B. | 在 0.1 mol•L-1 BA 溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| C. | 若一定量的上述两溶液混合后 pH=7,则 c(A- )=c(B+ ) | |
| D. | 若将 0.1 mol•L-1 BOH 溶液稀释至 0.001 mol•L-1,则溶液的 pH=9 |
6.某学生为了探究铁与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的铁粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
(气体体积为标准状况下测定的体积)
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3 min,原因是因反应为放热反应,温度升高,反应速率增大
(2)哪一段时段的反应速率最小4~5 min,原因是盐酸浓度太小,使反应减慢
(3)如果反应太激烈,为了减缓反应速率而又不影响产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)AE
A.蒸馏水 B.NaOH溶液 C.Na2CO3溶液 D.CuSO4溶液 E.NaCl溶液
(4)2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1 mol/(L•min).
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3 min,原因是因反应为放热反应,温度升高,反应速率增大
(2)哪一段时段的反应速率最小4~5 min,原因是盐酸浓度太小,使反应减慢
(3)如果反应太激烈,为了减缓反应速率而又不影响产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)AE
A.蒸馏水 B.NaOH溶液 C.Na2CO3溶液 D.CuSO4溶液 E.NaCl溶液
(4)2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1 mol/(L•min).
3.NA表示阿伏加德罗常数,下列有关说法中正确的是( )
| A. | 1mol H2O2晶体中含有2molH+,但不自由移动 | |
| B. | 1mol羟基中含有的电子数为7NA | |
| C. | 14g己烯和聚乙烯的混合物完全燃烧生成的CO2分子数为NA | |
| D. | 标况下,22.4L溴乙烷中含有的共价键数为7NA |
20.下列说法正确的是( )
| A. | 苯的同系物都能使酸性高锰酸钾溶液褪色 | |
| B. | 红外光谱、核磁共振氢谱都可以鉴别乙醇和甲醚 | |
| C. | 符合相同通式的不同物质一定是同系物 | |
| D. | 某有机物燃烧后只生成二氧化碳和水,则一定不含有氧元素 |
7.关于 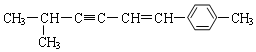 说法正确的是( )
说法正确的是( )
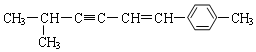 说法正确的是( )
说法正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为18个 |
4.下列说法正确的是( )
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在等体积、等物质的量浓度的Na2CO3、NaHCO两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| D. | 在Na2CO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
6.1.52g 铜镁合金恰好溶解于14.0mol/L的浓硝酸中,向反应后的溶液中加入0.1mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.则加入NaOH溶液的体积是( )
| A. | 400 mL | B. | 600 mL | C. | 500 mL | D. | 480 mL |



