题目内容
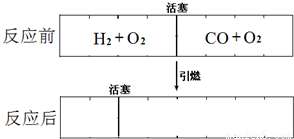
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器。左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体。同时引燃左右两侧的混合气,反应后恢复到标准状况。反应前后活塞位置如下图所示。则右侧混合气体中一氧化碳和氧气的物质的量之比是____________或___________。(液态水的体积忽略不计)
练习册系列答案
相关题目
15.已知X、Y、Z、W均为元素周期表中的短周期元素,具有如下特征:
(1)W的元素符号是S,其原子结构示意图为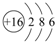 .
.
(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是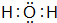 .
.
(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
 .
.(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是
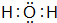 .
.(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.


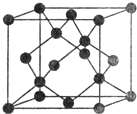 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: 液态HCl不能导电
液态HCl不能导电 g含有b个分子,则
g含有b个分子,则 g该混合气体在相同状况下所占的体积(L)应是
g该混合气体在相同状况下所占的体积(L)应是 B.
B. C.
C. D.
D.
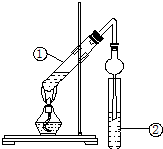 某同学用如图所示实验装置制取乙酸乙酯.在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸和2mL醋酸.用玻璃棒充分搅拌后将试管固定在铁架台上,在试管②中加入5mL饱和Na2CO3溶液,按图连接装置,用酒精灯对试管①加热,当观察到试管②中有明显现象时停止实验.
某同学用如图所示实验装置制取乙酸乙酯.在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸和2mL醋酸.用玻璃棒充分搅拌后将试管固定在铁架台上,在试管②中加入5mL饱和Na2CO3溶液,按图连接装置,用酒精灯对试管①加热,当观察到试管②中有明显现象时停止实验.