题目内容
将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )
A.5mol·L-1 B.3.25mol·L-1 C.7mol·L-1 D.6.25mol·L-1
练习册系列答案
相关题目
向四支试管中分别加入少量不同的无色无味溶液进行如下操作,结论正确的是
操作 | 现象 | 结论 | |
A | 先加硝酸,再滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 先加入H2O2溶液,再加KSCN溶液 | 生成血红色溶液 | 原溶液中有Fe3+原子 |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
17.现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复).
已知:①0.1mol/L A溶液中c(H+)>0.1mol/L;
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0,1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0,1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.


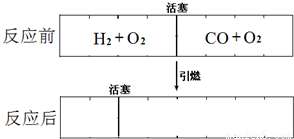

 同学的实验设计方案是否严密?请说明理由:________________________________。
同学的实验设计方案是否严密?请说明理由:________________________________。 液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象
液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象 的KNO3
的KNO3