题目内容
12. A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
(1)计算电极e上生成的气体在标准状况下的体积为2.8L.
(2)B溶液中的溶质为CuSO4.电解后,乙烧杯中溶液的pH=0. 若在B溶液中事先滴加紫色石蕊试液,d极(填写“c”或“d”)先变红.
分析 测得乙中c电极质量增加了8g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
(2)由分析可知,B为CuSO4,根据电子守恒计算乙中生成的氢离子的物质的量浓度,再求出pH;电解时,氢离子在阳极生成;
解答 解:测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)e电极上氢离子放电生成氢气,n(Cu)=$\frac{8g}{64g/mol}$=0.125mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.125mol×22.4L/mol=2.8L,
故答案为:2.8L;
(2)由分析可知,B为CuSO4,乙中电解方程式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,则Cu~2e-~2H+,所以溶液中的氢离子浓度为$\frac{0.25mol}{0.25L}$=1mol/L,则pH=0;电解时,氢氧根离子在阳极失电子生成氧气,同时生成氢离子,所以阳极附近有氢离子,即d极先变红;
故答案为:CuSO4;0;d.
点评 本题考查电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
18.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
3.某药物中间体的合成路线如下.下列说法正确的是( )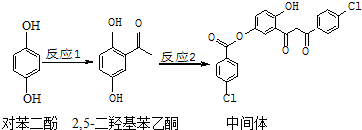

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
7.有关常温下pH均为3的酸酸和硫酸的说法正确的是( )
| A. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| B. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| C. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
17.亚硝酸钠(NaNO2)是重要的防腐剂.某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(3)第一组实验数据出现异常,造成这种异常的原因可能是A、C(填字母).
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
4.能正确表示下列反应的离子方程式是( )
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
1.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4 $→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$NgCl2(ag) $\stackrel{电解}{→}$Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$FeCl3(ag) $\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | Cu $\stackrel{稀硝酸}{→}$NO2 $\stackrel{水}{→}$NO |
2.X、Y、Z、W均是周期表中短周期元素,原子序数逐渐增大,有关信息如下:
(1)甲是X的最高价氧化物,X的最高正价是+4,甲的电子式为 ,X的气态氢化物电子式为
,X的气态氢化物电子式为 .
.
(2)W在元素周期表的位置第三周期第ⅦA族,用电子式表示化合物YW的形成过程
(3)乙是Y的最高价氧化物对应水化物,写出下列反应离子方程式:
①过量的甲通入乙溶液中CO2+OH-=HCO3-
②Z的单质和乙溶液反应2Al+2OH-+2H2O=2AlO2-+3H2↑
③W的单质与乙溶液反应Cl2+2OH-=Cl-+ClO-+H2O.
| 元素 | 相关信息 |
| X | X的原子L层电子数是K层电子数的2倍 |
| Y | Y是短周期元素中原子半径最大的元素(除稀有气体元素外) |
| Z | Z的原子最外层电子数等于电子层数 |
| W | W原子最外层电子数是X、Z原子最外层电子数之和 |
 ,X的气态氢化物电子式为
,X的气态氢化物电子式为 .
.(2)W在元素周期表的位置第三周期第ⅦA族,用电子式表示化合物YW的形成过程

(3)乙是Y的最高价氧化物对应水化物,写出下列反应离子方程式:
①过量的甲通入乙溶液中CO2+OH-=HCO3-
②Z的单质和乙溶液反应2Al+2OH-+2H2O=2AlO2-+3H2↑
③W的单质与乙溶液反应Cl2+2OH-=Cl-+ClO-+H2O.
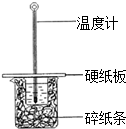 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定