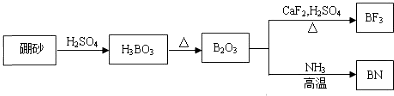
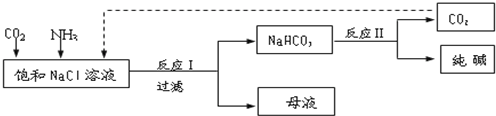
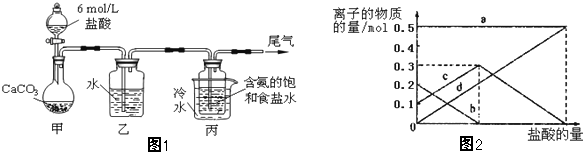
题目内容
高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理.
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行.
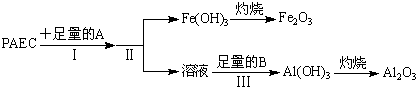
回答下列问题:
①PAFC中铁元素的化合价为 .
②步骤I中的试剂A是 (从“氢氧化钠溶液”、“氨水”中选择)
步骤Ⅲ中的试剂B是 .
③步骤Ⅱ的操作是 ,用到的主要玻璃仪器 .
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
废料(Fe、Fe2O3、FeO、Al2O3)
酸性溶液
PAEC
①在废料中加入过量稀盐酸,发生多个离子反应,请在空白处补全离子方程式:
FeO+2H+═Fe2++H2O Al2O3+6H+═2Al3++3H2O Fe2O3+6H+═2Fe3++3H2O
②所得酸性溶液中,不能确定是否一定存在的阳离子是 (填序号).
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行.

回答下列问题:
①PAFC中铁元素的化合价为
②步骤I中的试剂A是
步骤Ⅲ中的试剂B是
③步骤Ⅱ的操作是
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
废料(Fe、Fe2O3、FeO、Al2O3)
| 过量稀盐酸 |
| 试剂X |
| HCl(或NaOH) |
| 调节pH |
| 水解 |
| 聚合 |
①在废料中加入过量稀盐酸,发生多个离子反应,请在空白处补全离子方程式:
FeO+2H+═Fe2++H2O Al2O3+6H+═2Al3++3H2O Fe2O3+6H+═2Fe3++3H2O
②所得酸性溶液中,不能确定是否一定存在的阳离子是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液过滤后得到氢氧化铁灼烧得到氧化铁,滤液中通入过量二氧化碳气体分压生成氢氧化铝沉淀,灼烧得到氧化铝;
①依据元素化合价代数和为0计算铁元素化合价;
②步骤Ⅰ中的试剂A为氢氧化钠溶液;步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀;
③实现固体和液体的分离采用过滤的方法,根据过滤实验的一起来回答.
(2)①根据物质的性质结合发生的反应来回答;
②废料中加入过量稀盐酸,充分反应后得到甲溶液,甲溶液中含有AlCl3,由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是否存在Fe3+.
①依据元素化合价代数和为0计算铁元素化合价;
②步骤Ⅰ中的试剂A为氢氧化钠溶液;步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀;
③实现固体和液体的分离采用过滤的方法,根据过滤实验的一起来回答.
(2)①根据物质的性质结合发生的反应来回答;
②废料中加入过量稀盐酸,充分反应后得到甲溶液,甲溶液中含有AlCl3,由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是否存在Fe3+.
解答:
解:(1)为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液过滤后得到氢氧化铁灼烧得到氧化铁,滤液中通入过量二氧化碳气体分压生成氢氧化铝沉淀,灼烧得到氧化铝;
①设铁化合价是x,聚合氯化铝铁可表示为[AlFe(OH)nCl6-n]m,由此合物内化合价和为0得:3+x-n-(6-n)=0;
x=3,所以PAFC中铁元素的化合价为+3;
故答案为:+3;
②步骤Ⅰ中的试剂A为氢氧化钠溶液,③步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:氢氧化钠溶液;CO2;
③步骤Ⅱ是实现固体和液体的分离,采用过滤的方法,用到的玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:过滤;烧杯、玻璃棒、漏斗;
(2)①在废料中加入过量稀盐酸,其中的反应有:FeO+2H+═Fe2++H2O、Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O、Fe+2H+═Fe2++H2O、Fe+2Fe3+═3Fe2+,故答案为:Fe+2H+═Fe2++H2O、Fe+2Fe3+═3Fe2+;
②由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成是否有Fe3+,所得酸性溶液中,不能确定是否一定存在的阳离子为Fe3+,
故答案为:Fe3+.
①设铁化合价是x,聚合氯化铝铁可表示为[AlFe(OH)nCl6-n]m,由此合物内化合价和为0得:3+x-n-(6-n)=0;
x=3,所以PAFC中铁元素的化合价为+3;
故答案为:+3;
②步骤Ⅰ中的试剂A为氢氧化钠溶液,③步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:氢氧化钠溶液;CO2;
③步骤Ⅱ是实现固体和液体的分离,采用过滤的方法,用到的玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:过滤;烧杯、玻璃棒、漏斗;
(2)①在废料中加入过量稀盐酸,其中的反应有:FeO+2H+═Fe2++H2O、Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O、Fe+2H+═Fe2++H2O、Fe+2Fe3+═3Fe2+,故答案为:Fe+2H+═Fe2++H2O、Fe+2Fe3+═3Fe2+;
②由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成是否有Fe3+,所得酸性溶液中,不能确定是否一定存在的阳离子为Fe3+,
故答案为:Fe3+.
点评:本题考查了物质的分离提纯的实验探究知识,物质分离的方法和实验步骤分析判断,主要是物质性质的理解应用,掌握流程分析方法和物质性质是解题关键,题目难度中等.

练习册系列答案
相关题目
在一支50mL酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在20mL刻度处.若把滴定管中的溶液全部放入锥形瓶中,滴人3滴酚酞试液,然后以0.1mol/L NaOH溶液进行滴定,当溶液刚好变为浅红色时,消耗NaOH镕液的体积( )
| A、等于20mL |
| B、小于20mL |
| C、等于30mL |
| D、大于30ml. |
下列实验操作中不正确的是(多选) ( )
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- | ||
| B、水电离出的c(H+)=1×10-13的溶液:K+、Mg2+、NO3-、Cl- | ||
C、在
| ||
| D、甲基橙显红色的溶液:Na+、CO32-、NO3-、SO32- |
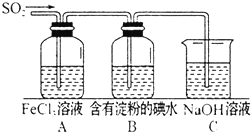 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: