题目内容
17.在水中加入下列物质,可使水的电离平衡正向移动的是( )| A. | Na2CO3 | B. | BaCl2 | C. | NaCl | D. | H2SO4 |
分析 酸、强酸酸式盐或碱抑制水电离,含有弱离子的盐促进水电离,据此分析解答.
解答 解:A.碳酸钠是强碱弱酸盐,碳酸根离子水解促进水电离,水的电离平衡正向移动,故A正确;
B.BaCl2是强酸强碱盐,不促进也不抑制水电离,故B错误;
C.NaCl是强酸强碱盐,不促进也不抑制水电离,故C错误;
D.硫酸在水溶液中完全电离,生成氢离子而使溶液呈强酸性,抑制水电离,水的电离平衡逆向移动,故D错误;
故选A.
点评 本题以盐类水解为载体考查水的电离,为高频考点,明确酸、碱、盐影响水电离原理是解本题关键,易错选项是B,注意硫酸氢钠在水溶液中或熔融状态下电离方式区别,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
20.已知:
①CaO(s)+H2O(1)═Ca(OH)2(s);△H1
②CaO(s)+2HCl(g)═CaCl2(s)+H2O(1);△H2
③NH3(g)+HCl(g)═NH4Cl(s);△H3
④Ca(OH)2(s)+2NH4Cl(s)═CaCl2(s)+2NH3(g)+2H2O(1);△H4
下列关于上述反应焓变的判断正确的是( )
①CaO(s)+H2O(1)═Ca(OH)2(s);△H1
②CaO(s)+2HCl(g)═CaCl2(s)+H2O(1);△H2
③NH3(g)+HCl(g)═NH4Cl(s);△H3
④Ca(OH)2(s)+2NH4Cl(s)═CaCl2(s)+2NH3(g)+2H2O(1);△H4
下列关于上述反应焓变的判断正确的是( )
| A. | △H1<0,△H3>0 | B. | △H1>△H4 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |
8.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”一定不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 充分开发利用天然纤维,停止使用各种化学合成材料 | |
| D. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
5.下列反应的离子方程式正确的是( )
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水与盐酸反应:H++OH-═H2O | |
| C. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
12.为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是( )
| A. | 加入NH4HSO4固体,v(H2)不变 | B. | 加入少量硫酸钠溶液,v(H2)减小 | ||
| C. | 加入CH3COONa固体,v(H2)不变 | D. | 滴加少量CuSO4溶液,v(H2)减小 |
2.下列叙述不正确的是( )
| A. | 配制0.1 mol•L-1的Na2SO3溶液490mL,需用500ml容量瓶 | |
| B. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) | |
| C. | 在标准状况下,将22.4L氨气溶于1L水中,得到1mol•L-1的氨水 | |
| D. | 10mL质量分数为70%的乙醇用10mL水稀释后;乙醇的质量分数小于35% |
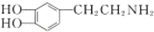 是一种重要的中枢神经传导物质,是用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由D(香兰素)与硝基甲烷反应后再经锌汞齐还原水解制得.合成过程如图所示:
是一种重要的中枢神经传导物质,是用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由D(香兰素)与硝基甲烷反应后再经锌汞齐还原水解制得.合成过程如图所示:
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$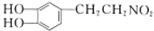 .
.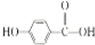 .
. (1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.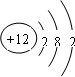 .
.