题目内容
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则NaHSO4溶液的pH是(已知lg2=0.3)( )
| A、2 | B、2.3 |
| C、2.6 | D、2.9 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,设出氢氧化钡溶液、硫酸氢钠溶液的体积,然后结合溶液的pH列式计算出二者体积之比,再计算出硫酸氢钠溶液中氢离子浓度浓度、溶液的pH.
解答:
解:pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol,
反应消耗的硫酸氢钠物质的量为:0.5x×10-2mol,
设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:10-3mol/L,
则:
=10-3,
解得:x:y=1:4,
即硫酸氢钠溶液的体积y=4x,
则硫酸氢钠的物质的量浓度为:c(NaHSO4)=
=1.25×10-3mol/L,
该硫酸氢钠溶液中氢离子浓度为:c(H+)=c(NaHSO4)=1.25×10-3mol/L,
溶液的pH=-lg1.25×10-3mol/L=3-lg
=3+3lg2-1=2+0.9=2.9,
故选D.
反应消耗的硫酸氢钠物质的量为:0.5x×10-2mol,
设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:10-3mol/L,
则:
| x×10-2-0.5x×10-2 |
| x+y |
解得:x:y=1:4,
即硫酸氢钠溶液的体积y=4x,
则硫酸氢钠的物质的量浓度为:c(NaHSO4)=
| 0.5x×10-2 |
| 4x |
该硫酸氢钠溶液中氢离子浓度为:c(H+)=c(NaHSO4)=1.25×10-3mol/L,
溶液的pH=-lg1.25×10-3mol/L=3-lg
| 10 |
| 8 |
故选D.
点评:本题考查了溶液pH的计算方法,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,正确分析、理解题干信息,求算出两溶液的体积之比为解答本题的关键.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
在水溶液中能大量共存的一组是( )
| A、Fe2+ Al3+ ClO- Cl- |
| B、K+Fe3+OH- NO3- |
| C、NH4+ Na+ Br- SO42- |
| D、Na+ H+ SiO32- SO42- |
下列离子方程式书写正确的是( )
A、澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO
| ||
B、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO
| ||
| C、锌和稀硝酸的反应:Zn2++2H+=Zn2++H2 | ||
| D、CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+ |
某有机物结构简式如图所示(未表示出其空间构型).下列它的性质描述不正确的是( )
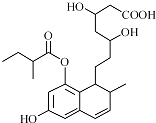

| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、58.5 g的NaCl固体中含有NA个氯化钠分子 |
| B、标准状况下,22.4 L二氯甲烷的分子数约为 NA个 |
| C、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| D、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA |
几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | X | R | T |
| 原子半径/nm | 0.191 | 0.102 | 0.154 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A、L单质的熔点比R单质的高 |
| B、T对应的氢化物的沸点比X对应的氢化物高 |
| C、R单质在氧气中燃烧生成R2O2 |
| D、L、X形成的简单离子核外电子数相等 |
下列氧化还原反应中,实际参加反应的氧化剂与还原剂物质的量之比正确的是( )
①2H2S+SO2=3S+2H2O; 1:2
②6HNO3(浓)+S=H2SO4+6NO2+2H2O; 6:1
③Fe+4HNO3=Fe(NO3)3+NO+2H2O; 1:1
④2Na2O2+2H2O=4NaOH+O2; 1:1.
①2H2S+SO2=3S+2H2O; 1:2
②6HNO3(浓)+S=H2SO4+6NO2+2H2O; 6:1
③Fe+4HNO3=Fe(NO3)3+NO+2H2O; 1:1
④2Na2O2+2H2O=4NaOH+O2; 1:1.
| A、只有①正确 |
| B、只有③ |
| C、只有①和④ |
| D、①②③④都正确 |
下列热化学方程式或离子方程式中,正确的是( )
| A、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| B、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3↓+CaCO3↓+2H2O |
| C、乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-akJ/mol |
| D、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
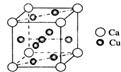 是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为
是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为
是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为