题目内容
下列说法正确的是( )
| A、原电池的负极是电子流出的一极,电极上发生氧化反应 |
| B、原电池反应一定是释放能量的置换反应 |
| C、电解可以使通常条件下不能发生的氧化还原反应得以发生 |
| D、电解池中,连接电源正极的一极叫阳极,发生还原反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池是将化学能转化为电能的装置,而电解池是将电能转化为化学能的装置,原电池的负极发生氧化反应,正极发生还原反应,电解池的阳极发生氧化反应,阴极发生还原反应,以此解答该题.
解答:
解:A.原电池的负极发生氧化反应,为电子流出的一极,故A正确;
B.原电池不一定为置换反应,如氢氧燃料电池,故B错误;
C.电解可以将电能转化为化学能,可以使通常条件下不能发生的氧化还原反应得以发生,如以铜为阳极,硫酸为电解质时,可生成硫酸铜和氢气,故C正确;
D.电解池中,连接电源正极的一极叫阳极,发生氧化反应,故D错误.
故选AC.
B.原电池不一定为置换反应,如氢氧燃料电池,故B错误;
C.电解可以将电能转化为化学能,可以使通常条件下不能发生的氧化还原反应得以发生,如以铜为阳极,硫酸为电解质时,可生成硫酸铜和氢气,故C正确;
D.电解池中,连接电源正极的一极叫阳极,发生氧化反应,故D错误.
故选AC.
点评:本题考查原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极方程式的书写,注重相关基础知识的积累,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA代表阿伏伽德罗常数,下列对于0.3mol/L的K2SO4溶液的说法不正确的是( )
A、2L溶液中含有0.6NA个S
| ||
| B、2L溶液中K+离子的浓度为1.2mol/L | ||
| C、1L溶液中含K+离子的质量是23.4g | ||
| D、1L溶液中含溶质阴阳离子的总数为0.9NA个 |
下列关于实验操作能实现目的是( )
A、 分离碘酒中的碘和酒精 |
B、 实验室制氨气 |
C、 除去Cl2中的HCl |
D、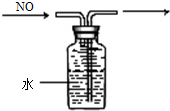 排水集气法收集NO |
下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A、Fe2+、H+、NO3-、Cl- |
| B、Na+、H+、SO42-、ClO- |
| C、Ca2+、Na+、CO32-、NO3- |
| D、Fe3+、SO42-、SCN-、Na+ |
设NA为阿伏加德罗常数.下列叙述不正确的是( )
| A、标准状况下,2.24L Cl2完全溶于足量的水中,转移电子的数目为0.1NA |
| B、常温常压下,11.0g C3H8中含有共价键的数目为2.5NA |
| C、常温常压下,1L 0.1mol?L-1 NH4NO3溶液中NO3-的数目为0.1NA |
| D、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
下列说法不正确的是( )
| A、分子式为C5H10O2的羧酸共有3种 |
| B、分子式为C3H9N的异构体共有4个 |
| C、某烷烃CnH2n+2的一个分子中,含有共价键的数目是3n+1 |
| D、某烷烃CnH2n+2的一个分子中,含有非极性键的数目是n-1 |

 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0).
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0).
