题目内容
能源是影响全球经济和生活的首要因素.已知下列热化学方程式:
①H2(g)+
O2(g)═H2O(l)△H=-285kJ/mol
②H2O(g)═H2(g)+
O2(g)△H=+241.8kJ/mol
③C(s)+
O2(g)═CO(g)△H=-110.4kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
如果完全燃烧2g H2生成液态水,那么放出的热量为 kJ.
①H2(g)+
| 1 |
| 2 |
②H2O(g)═H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
如果完全燃烧2g H2生成液态水,那么放出的热量为
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:反应H2(g)+
O2(g)═H2O(l)△H=-285kJ/mol的意义:常温下,完全燃烧1mol氢气,生成液态水放出的热量是285kJ,根据热化学方程式的意义来回答.
| 1 |
| 2 |
解答:
解:根据热化学方程式的意义,结合反应①H2(g)+
O2(g)═H2O(l)△H=-285kJ/mol,如果完全燃烧2g即1molH2生成液态水,那么放出的热量为285kJ×2=570kJ.
故答案为:570.
| 1 |
| 2 |
故答案为:570.
点评:本题考查学生热化学方程式的意义,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列说法中一定正确的是( )
| A、1mol甲烷中的氢原子被氯原子完全取代,需要Cl2分子数为2NA |
| B、1mol铁参加化学反应,失去的电子数为3NA |
| C、标准状况下,22.4L乙烯中含有的共价键数为6NA |
| D、常温常压下,100g98%的硫酸溶液中所含的氧原子数为4NA |
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法错误的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法错误的是( )| A、该电池工作时将化学能转化为电能 |
| B、电流从电极b经外电路流向电极a |
| C、该电池中的电极b是正极 |
| D、在电极a上发生还原反应 |
对于反应Zn+H2SO4═ZnSO4+H2↑,下列措施不能增大氢气生成速率的是( )
| A、使用18.4mol?L-1的硫酸 |
| B、升高溶液的温度 |
| C、向溶液中加入少量铜粉 |
| D、把锌块(片)换成锌粉 |
 已知:A、B为单质,C为淡黄色固体;A、B、C、D、E、F有如图所示的转化关系.
已知:A、B为单质,C为淡黄色固体;A、B、C、D、E、F有如图所示的转化关系.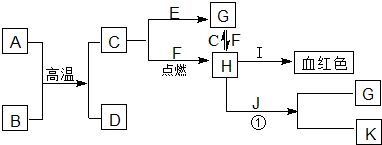
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: