题目内容
某可逆反应2A+B?2C为放热反应,则反应物的总能量 (填“大于”或“小于”)生成物的总能量.当其他条件不变时,升高温度,化学平衡向 (填“正反应”或“逆反应”)方向移动.
考点:化学平衡的影响因素
专题:化学平衡专题
分析:当反应物的能量高于生成物的能量,反应是放热的,反之是吸热的,升高温度,化学平衡向着吸热方向进行,据此来回答.
解答:
解:当反应物的能量高于生成物的能量,反应是放热的,可逆反应2A+B?2C为放热反应,则反应物的总能量大于生成物的总能量,升高温度,化学平衡向着吸热方向进行,所以该反应向着逆方向进行.
故答案为:大于;逆方向.
故答案为:大于;逆方向.
点评:注意从反应物、产物具有的能量高低角度判断化学反应的吸放热情况的方法以及化学平衡移动原理的应用,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 某原电池结构如右图所示,下列有关该原电池的说法正确的是( )
某原电池结构如右图所示,下列有关该原电池的说法正确的是( )| A、铜棒为负极 |
| B、镁棒发生还原反应 |
| C、电子从铜棒经外电路流向镁棒 |
| D、电池反应为Mg+2H+=Mg2++H2↑ |
关于化学反应速率、反应限度的下列说法中不正确的是( )
| A、其他条件不变时,升高温度,化学反应速率加快 |
| B、其他条件不变时,增大浓度,化学反应速率加快 |
| C、化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 |
| D、化学反应达到反应限度时,正反应的速率与逆反应的速率相等 |
下列措施不能加快H202分解反应速率的是( )
| A、加热 |
| B、加FeCl2作催化剂 |
| C、加水稀释 |
| D、加MnO2作催化剂 |

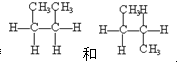


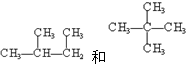




 下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族; E是无色溶液.在适当的条件下,它们可以按下面框图进行反应.
下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族; E是无色溶液.在适当的条件下,它们可以按下面框图进行反应. ③CH3CHO、④CH3COOH中,俗称醋酸的是
③CH3CHO、④CH3COOH中,俗称醋酸的是