题目内容
将51.2g铜恰好完全溶于V mL 10mol/L硝酸中得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92L(标准状况),这些气体恰好能被500mL2、0mol/L NaOH溶液完全吸收,得到500mL(假设吸收气体后溶液体积不变)钠盐溶液.发生的反应有:
N2O4?2NO2 NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
通过计算回答下列问题:
(1)硝酸铜溶液中硝酸根离子的物质的量为 ,V= .
(2)上述钠盐溶液中硝酸钠的物质的量浓度为 .
(3)向上述硝酸铜溶液中加入足量的稀硫酸,再加入足量铜粉,有W g铜完全溶解,将收集到的气体(只有NO生成)全部收集于一试管中,并将充满该气体的试管倒立于盛水的水槽里,再向试管里充入一定量的氧气,最终恰好使溶液充满试管.①W= .
②通入的氧气在标况下的体积为 .
N2O4?2NO2 NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
通过计算回答下列问题:
(1)硝酸铜溶液中硝酸根离子的物质的量为
(2)上述钠盐溶液中硝酸钠的物质的量浓度为
(3)向上述硝酸铜溶液中加入足量的稀硫酸,再加入足量铜粉,有W g铜完全溶解,将收集到的气体(只有NO生成)全部收集于一试管中,并将充满该气体的试管倒立于盛水的水槽里,再向试管里充入一定量的氧气,最终恰好使溶液充满试管.①W=
②通入的氧气在标况下的体积为
考点:有关混合物反应的计算,硝酸的化学性质
专题:守恒法
分析:(1)n(Cu)=
=0.8mol,铜和硝酸恰好完全反应,则溶液中的溶质是Cu(NO3)2,根据铜离子计算硝酸根离子的物质的量;
氮氧化物被NaOH溶液吸收生成NaNO2、NaNO3,根据钠离子和N原子之间的关系式计算被还原的硝酸,原溶液中硝酸为参加氧化还原反应和起酸作用的硝酸;
(2)根据转移电子守恒计算硝酸钠的物质的量浓度;
(3)①硝酸铜溶液中含有n(NO3-)为1.6mol,加入硫酸后,发生反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,根据硝酸根离子和铜之间的关系式计算溶解Cu的质量;
②根据转移电子守恒知,铜失去电子总数等于氧气得到电子总数,据此计算氧气体积.
| 51.2g |
| 64g/mol |
氮氧化物被NaOH溶液吸收生成NaNO2、NaNO3,根据钠离子和N原子之间的关系式计算被还原的硝酸,原溶液中硝酸为参加氧化还原反应和起酸作用的硝酸;
(2)根据转移电子守恒计算硝酸钠的物质的量浓度;
(3)①硝酸铜溶液中含有n(NO3-)为1.6mol,加入硫酸后,发生反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,根据硝酸根离子和铜之间的关系式计算溶解Cu的质量;
②根据转移电子守恒知,铜失去电子总数等于氧气得到电子总数,据此计算氧气体积.
解答:
解:(1)氮的氧化物与NaOH反应恰好生成硝酸钠和亚硝酸钠,由电荷守恒及原子个数守恒得,氮的氧化物中N原子的物质的量n(N)=n(NO3-)+n(NO2-)=n(Na+)=2.0mol/L×0.50L=1.0mol,
n(Cu)=
=0.8mol,硝酸铜溶液中含有n(NO3-)=2n(Cu 2+)=1.6mol,
由于硝酸恰好和Cu完全反应,根据氮原子守恒得,酸的物质的量等于氮的氧化物中氮的物质的量与硝酸铜中氮的物质的量之和,n(HNO3)=1.6mol+1.0mol=2.6mol,所以V(HNO3)=
×1000mL/L=260mL,
故答案为:1.6mol;260mL;
(2)根据得失电子守恒,铜失去电子的物质的量等于转化为NaNO2的那部分硝酸得到电子的物质的量,由HNO3→NaNO2得到2e-,所以n(NaNO2)×2=n(Cu)×2,n(NaNO2)=0.80mol,n(NaNO3)=1.0mol-0.8mol=0.2mol,则C(NaNO3)=
=0.4 mol/L,故答案为:0.4 mol/L;
(3)①硝酸铜溶液中含有n(NO3-)为1.6mol,加入硫酸后,发生反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,根据3Cu----2NO3-得溶解铜的质量=
×3×64g/mol=153.6g,
故答案为:153.6;
②根据转移电子守恒知,铜失去电子总数等于氧气得到电子总数,则消耗氧气体积=
×22.4L/mol=26.88 L,故答案为:26.88L.
n(Cu)=
| 51.2g |
| 64g/mol |
由于硝酸恰好和Cu完全反应,根据氮原子守恒得,酸的物质的量等于氮的氧化物中氮的物质的量与硝酸铜中氮的物质的量之和,n(HNO3)=1.6mol+1.0mol=2.6mol,所以V(HNO3)=
| 2.6mol |
| 10mol/L |
故答案为:1.6mol;260mL;
(2)根据得失电子守恒,铜失去电子的物质的量等于转化为NaNO2的那部分硝酸得到电子的物质的量,由HNO3→NaNO2得到2e-,所以n(NaNO2)×2=n(Cu)×2,n(NaNO2)=0.80mol,n(NaNO3)=1.0mol-0.8mol=0.2mol,则C(NaNO3)=
| 0.2mol |
| 0.50L |
(3)①硝酸铜溶液中含有n(NO3-)为1.6mol,加入硫酸后,发生反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,根据3Cu----2NO3-得溶解铜的质量=
| 1.6mol |
| 2 |
故答案为:153.6;
②根据转移电子守恒知,铜失去电子总数等于氧气得到电子总数,则消耗氧气体积=
| ||
| 4 |
点评:本题考查了混合物的计算,明确过程中发生的反应是解本题关键,再结合原子守恒、转移电子守恒进行计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
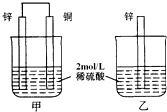 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |
已知可逆反应mA(g)+nB(g)?xC(g) 在某一时刻的反应速率为:v(A)=a mol?L-1?min-1,
v(B)=b mol?L-1?min-1,v(C)=c mol?L-1?min-1,则x的值为( )
v(B)=b mol?L-1?min-1,v(C)=c mol?L-1?min-1,则x的值为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
以下原子轨道符号不正确的是( )
| A、1s | B、3d | C、2f | D、2p |
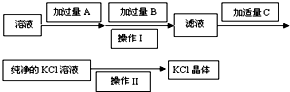 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作: