题目内容
写出下列反应的离子方程式:
(1)醋酸与氢氧化钠溶液反应 .
(2)氧化铝与盐酸溶液反应 .
(3)碳酸钠溶液与氯化钙溶液反应 .
(4)过氧化钠与水反应 .
(5)等物质的量溴化亚铁溶液与氯气反应 .
(1)醋酸与氢氧化钠溶液反应
(2)氧化铝与盐酸溶液反应
(3)碳酸钠溶液与氯化钙溶液反应
(4)过氧化钠与水反应
(5)等物质的量溴化亚铁溶液与氯气反应
考点:离子方程式的书写
专题:离子反应专题
分析:(1)醋酸和氢氧化钠反应生成醋酸钠和水;
(2)氧化铝和盐酸反应生成氯化铝和水;
(3)碳酸钠和氯化钙反应生成碳酸钙和氯化钠;
(4)过氧化钠和水反应生成氢氧化钠和氧气;
(5)等物质的量溴化亚铁溶液与氯气时,亚铁离子完全被氧化,有一半的溴离子被氧化.
(2)氧化铝和盐酸反应生成氯化铝和水;
(3)碳酸钠和氯化钙反应生成碳酸钙和氯化钠;
(4)过氧化钠和水反应生成氢氧化钠和氧气;
(5)等物质的量溴化亚铁溶液与氯气时,亚铁离子完全被氧化,有一半的溴离子被氧化.
解答:
解:(1)醋酸和氢氧化钠反应生成醋酸钠和水,离子方程式为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(2)氧化铝和盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+=2Al3++3H3O,故答案为:Al2O3+6H+=2Al3++3H3O;
(3)碳酸钠和氯化钙反应生成碳酸钙和氯化钠,离子方程式为CO32-+Ca2+=CaCO3↓,故答案为:CO32-+Ca2+=CaCO3↓;
(4)过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)等物质的量溴化亚铁溶液与氯气时,亚铁离子完全被氧化,有一半的溴离子被氧化,离子方程式为2Cl2 +2Fe2++2Br-=4Cl-+2Fe3++Br2,故答案为:2Cl2 +2Fe2++2Br-=4Cl-+2Fe3++Br2.
(2)氧化铝和盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+=2Al3++3H3O,故答案为:Al2O3+6H+=2Al3++3H3O;
(3)碳酸钠和氯化钙反应生成碳酸钙和氯化钠,离子方程式为CO32-+Ca2+=CaCO3↓,故答案为:CO32-+Ca2+=CaCO3↓;
(4)过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)等物质的量溴化亚铁溶液与氯气时,亚铁离子完全被氧化,有一半的溴离子被氧化,离子方程式为2Cl2 +2Fe2++2Br-=4Cl-+2Fe3++Br2,故答案为:2Cl2 +2Fe2++2Br-=4Cl-+2Fe3++Br2.
点评:本题考查了离子方程式的书写,明确发生反应实质是解本题关键,根据离子方程式书写规则进行书写,注意(5)中离子反应先后顺序及反应物的量,反应物的量不同导致其离子方程式不同,为易错点.

练习册系列答案
相关题目
科学家对物质性质的推断一般要基于一些实验事实.下列能说明苯与一般的烯烃性质不同的事实是( )
①苯分子是高度对称的平面型分子 ②苯不与溴水反应 ③苯不与酸性KMnO4溶液发生反应 ④1mol苯在一定条件下可与3molH2进行加成反应.
①苯分子是高度对称的平面型分子 ②苯不与溴水反应 ③苯不与酸性KMnO4溶液发生反应 ④1mol苯在一定条件下可与3molH2进行加成反应.
| A、②③ | B、①②③ |
| C、①③④ | D、全部 |
在同浓度的KHCO3和NH4HCO3溶液中,c(CO32-)和c(HCO3-)大的分别是( )
| A、KHCO3、NH4HCO3 |
| B、NH4HCO3、KHCO3 |
| C、KHCO3、KHCO3 |
| D、NH4HCO3、NH4HCO3 |
下列叙述不正确的是( )
| A、Na、Mg、Al的第一电离能依次减弱 |
| B、H2S、H2O、HF的稳定性依次增强 |
| C、NaOH、Mg(OH)2、Al(OH)3的碱性依次减弱 |
| D、H4SiO4、H2CO3、H2SO4酸性依次增强 |
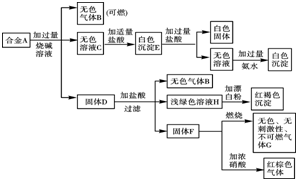 现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.