题目内容
15.下列有关热化学方程式的叙述正确的是( )| A. | 已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知中和热为△H=-57.3 kJ/mol,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 |
分析 A.生成物应为液态水;
B.能量越低越稳定;
C.1mol稀硫酸和足量稀NaOH溶液反应生成2mol水;
D.气态硫的能量大于固态硫,放出的热量越多,焓变越小.
解答 解:A.已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(l)△H=-890.3 kJ/mol,故A错误;
B.已知C(石墨,s)═C(金刚石,s)△H>0,说明石墨的能量较低,石墨比金刚石稳定,故B错误;
C.1mol稀硫酸和足量稀NaOH溶液反应生成2mol水,反应热为2×57.3 kJ/mol,故C错误;
D.气态硫的能量大于固态硫,因此气态硫燃烧放出的热量多,放出的热量越多,焓变越小,因此△H1<△H2,故D正确;
故选D.
点评 本题考查了反应热和焓变,侧重于热化学方程式的书写、物质的稳定性、中和热、焓变的比较,综合性强,难度中等.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
5.下列各种物质中,既能与强酸反应,又能与强碱反应的是( )
①Al ②AlCl3 ③Al2O3 ④Al(OH)3 ⑤NaHCO3.
①Al ②AlCl3 ③Al2O3 ④Al(OH)3 ⑤NaHCO3.
| A. | 全部 | B. | ①③④⑤ | C. | ②③④⑤ | D. | ①②④ |
3.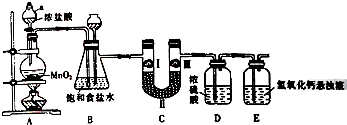 氯气在工农业生产在应用非常广泛.如图是实验室制备氯气并进行一系列相关实验的装置.
氯气在工农业生产在应用非常广泛.如图是实验室制备氯气并进行一系列相关实验的装置.
已知:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(1)仪器a的名称为分液漏斗.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl气体;装置B也作安全瓶,用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的作用是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入c(填字母).
(4)装置E中氢氧化钙悬浊液的作用是吸收多余的Cl2,防止污染空气;请写出相应反应的离子方程式:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O.
 氯气在工农业生产在应用非常广泛.如图是实验室制备氯气并进行一系列相关实验的装置.
氯气在工农业生产在应用非常广泛.如图是实验室制备氯气并进行一系列相关实验的装置.已知:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(1)仪器a的名称为分液漏斗.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl气体;装置B也作安全瓶,用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的作用是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入c(填字母).
| 选项 | a | b | c |
| Ⅰ | 湿润的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
20.按图甲进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是( )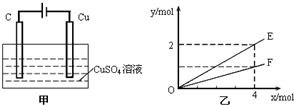

| A. | E表示生成铜的物质的量 | B. | E表示生成硫酸的物质的量 | ||
| C. | F表示反应消耗水的物质的量 | D. | E表示反应生成氧气的物质的量 |
5.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| C. | 饱和新制氯水中:Na+、K+、NO3-、I- | |
| D. | 使酚酞试液变红的溶液:Na+、K+、SiO32-、NO3- |
 铅蓄电池的电池总反应式为:
铅蓄电池的电池总反应式为: