题目内容
11.下列说法正确的是( )| A. | 14C与 12C互称同位素;O2与O3是氧元素的同素异形体 | |
| B. | 钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用 | |
| C. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| D. | SO2和NO2属于酸性氧化物,Na2O和Fe3O4属于碱性氧化物 |
分析 A.有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;相同元素组成,不同形态的单质互为同素异形体;
B.镀锌铁皮镀层破损后,铁做正极被保护;
C.石油的分馏属于物理变化,煤的干馏、电解质溶液导电均属于化学变化;
D.氧化物只有两种元素,且必须有氧元素,酸性氧化物是与碱反应生成盐和水的氧化物,溶于水一般生成酸的氧化物;碱性氧化物是能和酸反应生成盐和水的氧化物,两性氧化物既能和酸反应生成盐和水,又能和碱反应生成盐和水.
解答 解:A.14C与12C质子数相同都为6,中子数不同分别为8、6,互为同位素,O2与O3都是由氧元素形成的不同单质,互为同素异形体,故A正确;
B.钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后,铁做正极被保护,故铁仍被保护,故B错误;
C.石油分馏是根据石油中各成分的沸点不同而分离的,变化过程中没有新物质生成,属于物理变化,煤的干馏是将煤隔绝空气加强热,分解生成煤焦油、煤气、焦炭等新物质,属于化学变化,电解质溶液导电是电解的过程,属于化学变化,故C错误;
D.依据酸性氧化物和碱性氧化物的概念分析判断,NO2不是酸性氧化物、Fe3O4不属于碱性氧化物,故D错误.
故选A.
点评 本题考查学生常见物质的概念、金属的腐蚀等知识,注意Fe3O4不属于碱性氧化物,要求平时注意知识的灵活应用,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
2.下列反应中溶液中的H+浓度显著增大的是( )
| A. | 将SO2通入品红溶液中 | B. | 将Cl2通入KI溶液中 | ||
| C. | 将SO2通入溴水中 | D. | 将H2S通入硝酸溶液中 |
6.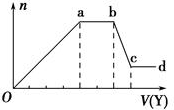 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示.(提示:铵根和偏铝酸根不能共存)
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.





 .
. .
.