题目内容
在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br2?2HBr.已知加入1molH2和2molBr2 时,达到平衡状态生成a molHBr.在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
| 编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| ① | 2 | 4 | 0 | |
| ② | 1 | 0.5a | ||
| ③ | m | n(n≥2m) | ||
考点:等效平衡,化学平衡建立的过程
专题:化学平衡专题
分析:容积固定的密闭容器中,保持一定温度,进行以下反应:Br2(g)+H2(g)?2HBr(g),反应前后气体体积不变,把容器内的物质都转化为反应物,如果与原来加入的量成比例,则为等效平衡,平衡时各组分的体积分数不变;据此分析.
解答:
解:①已知加入1molH2和2molBr2 时,达到平衡状态生成a molHBr,根据等效平衡原理:加入2molH2和4molBr2 时,反应物的起始量是原来的2倍,则平衡时HBr的量是原平衡的2倍,即HBr的物质的量为2amol,故答案为:2a;
②若平衡时HBr的物质的量为0.5amol,则平衡时HBr的量是原来平衡HBr的物质的量的一半,所以起始时应加入0.5mol H2和1mol Br2,已知起始时有HBr1mol,相当于有0.5mol H2和0.5mol Br2,所以还需0.5molBr2,故起始时只需加入0.5molBr2,故答案为:0;0.5;
③若开始时加入m mol H2和nmol Br2,设起始HBr的物质的量应当为x,则(m+
):(n+
)=1:2,所以x=2(n-2m),全部折算成反应物后有H2的物质的量为m+
=n-m,则平衡时HBr的物质的量为:
=
,所以n(HBr)=a(n-m),故答案为:2(n-2m);a(n-m);
②若平衡时HBr的物质的量为0.5amol,则平衡时HBr的量是原来平衡HBr的物质的量的一半,所以起始时应加入0.5mol H2和1mol Br2,已知起始时有HBr1mol,相当于有0.5mol H2和0.5mol Br2,所以还需0.5molBr2,故起始时只需加入0.5molBr2,故答案为:0;0.5;
③若开始时加入m mol H2和nmol Br2,设起始HBr的物质的量应当为x,则(m+
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| 1 |
| n-m |
| a |
| n(HBr) |
点评:本题考查了化学平衡的计算,注意利用等效平衡原理解答,难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
杀虫剂“阿乐丹”的结构表示为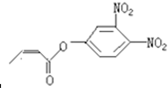 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A、遇FeCl3溶液均显紫色 |
| B、均能发生银镜反应 |
| C、均能与溴水发生反应 |
| D、均能与NaOH溶液发生反应下列 |
在一个固定容积的密闭容器中发生如下反应:2A(气)+B(气)?3C(气)+D(气),当加入4molA和2molB,达化学平衡时,C的物质的量浓度为m mol/L.若维持温度不变,按下列四种配比为起始物质,达到化学平衡后,C仍为m mol/L的是( )
| A、2molA+1molB |
| B、6molC+2molD |
| C、3molC+1molD |
| D、4molA+2molB+3molC |

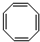 )分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
)分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
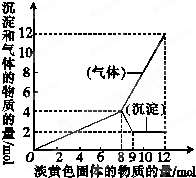 (1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.
(1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.