题目内容
7.用价层电子对互斥模型判断NH4+的构型是( )| A. | V形 | B. | 正四面体形 | C. | 三角锥形 | D. | 平面三角形 |
分析 根据价层电子对互斥理论确定中心原子杂化方式及粒子的空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:NH4+中心原子N电子对数=4+$\frac{5-1-1×4}{2}$=4,中心原子是SP3杂化,没有一对孤电子对,所以NH4+的立体结构是正四面体型,
故选B.
点评 本题考查了NH4+空间构型的判断,根据价层电子对互斥理论来分析解答即可,题目难度不大,注意判断中心原子的价层电子对以及孤对电子数的判断.

练习册系列答案
相关题目
17.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. | 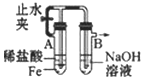 较长时间观察Fe(OH)2白色沉淀 | ||
| C. | 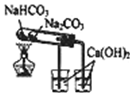 验证NaHCO3和Na2CO3的热稳定性 | D. | 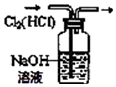 除去Cl2中HCl |
19.下列溶液肯定显酸性的是( )
| A. | 和金属铝反应产生氢气的溶液 | B. | 加酚酞显无色的溶液 | ||
| C. | pH<7的溶液 | D. | c(H+)>c(OH-)的溶液 |
16.NA表示阿伏加罗常数的值,下列说法正确的是( )
| A. | 2.2g CO2中含有的分子数为0.1NA | |
| B. | 0.5mol Na2CO3固体中含有的Na+数为0.5NA | |
| C. | Na2O2与足量水反应时,生成1molO2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的碳原子数为0.2NA |
1.中科大教授联合美国科学家发现雾霾形成与硫酸氢铵有关,NH4HSO4属于( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
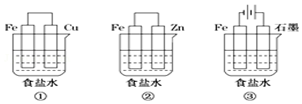 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.