题目内容
下列事实的解释正确的是( )
| A、浓H2SO4和浓盐酸混合可制HCl气体,是利用了浓H2SO4的强酸性 |
| B、SO2使溴水褪色,是利用了SO2的漂白性 |
| C、将SO2、SO3混合气体通入氯化钡溶液中,出现浑浊,是因为有BaSO4生成 |
| D、反应“CuSO4+H2S=CuS↓+H2SO4”能进行,是利用了较强酸制较弱酸的原理 |
考点:浓硫酸的性质,二氧化硫的化学性质
专题:元素及其化合物
分析:A.实验室将浓盐酸与浓硫酸混合制备HCl气体是利用难挥发性酸制易挥发性酸;
B.SO2使溴水褪色,是利用了SO2的还原性;
C.盐酸的酸性大于亚硫酸,亚硫酸与氯化钡不反应,硫酸与氯化钡反应生成硫酸钡沉淀;
D.反应“CuSO4+H2S=CuS↓+H2SO4”能进行,利用的是CuS的溶解度很小,有利于平衡正向移动.
B.SO2使溴水褪色,是利用了SO2的还原性;
C.盐酸的酸性大于亚硫酸,亚硫酸与氯化钡不反应,硫酸与氯化钡反应生成硫酸钡沉淀;
D.反应“CuSO4+H2S=CuS↓+H2SO4”能进行,利用的是CuS的溶解度很小,有利于平衡正向移动.
解答:
解:A.实验室将浓盐酸与浓硫酸混合制备HCl气体是利用难挥发性酸制易挥发性酸,利用了浓H2SO4的难挥发性,故A错误;
B.SO2使溴水褪色,是利用了SO2的还原性,与溴水发生氧化还原反应,故B错误;
C.盐酸的酸性大于亚硫酸,亚硫酸与氯化钡不反应,硫酸与氯化钡反应生成硫酸钡沉淀,故C正确;
D.反应“CuSO4+H2S=CuS↓+H2SO4”能进行,利用的是CuS的溶解度很小,是弱酸制强酸,故D错误,
故选C.
B.SO2使溴水褪色,是利用了SO2的还原性,与溴水发生氧化还原反应,故B错误;
C.盐酸的酸性大于亚硫酸,亚硫酸与氯化钡不反应,硫酸与氯化钡反应生成硫酸钡沉淀,故C正确;
D.反应“CuSO4+H2S=CuS↓+H2SO4”能进行,利用的是CuS的溶解度很小,是弱酸制强酸,故D错误,
故选C.
点评:本题考查化合物的性质及反应原理,难度不大.要注意基础知识的积累.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
A、钾离子结构示意图: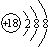 | ||
| B、乙醇的分子式:CH3CH2OH | ||
C、水合氢离子电子式: | ||
D、中子数为18的硫原子:
|
下列有关化工生产的说法正确的是( )
| A、将氯气通入澄清石灰水制取漂白粉 |
| B、电解饱和食盐水溶液制取金属钠 |
| C、SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 |
| D、用98.3%的浓H2SO4吸收SO3,目的是防止形成酸雾,使SO3吸收完全 |
两份足量的铝片分别与盐酸和氢氧化钠溶液反应,产生的气体在同条件下的体积比为1:1,消耗的盐酸和氢氧化钠的物质的量的比为( )
| A、1:1 | B、3:1 |
| C、1:3 | D、2:3 |
下列溶液中各离子的浓度由大到小排列顺序正确的是( )
| A、CH3COONa溶液中 c (Na+)>c (CH3COO-)>c (OH-)>c (H+) |
| B、(NH4)2SO4溶液中:c (SO42-)>c (NH4+)>c (H+)>c (OH-) |
| C、Na2CO3溶液中:c (Na+)>C (CO32-)>C (HCO3-)>c (OH-)>c (H+) |
| D、NaHS溶液中:c (Na+)>C (HS-)>C (S2-)>c (OH-)>c (H+) |