题目内容
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数
(2)ⅦA族元素氢化物的沸点
(3)第三周期元素单质的熔点
(4)第三周期元素的最高正化合价
(5)IA族元素单质熔点
(6)F-、Na+、Mg2+、Al3+四种离子的离子半径
(7)部分短周期元素的原子半径
(8)短周期元素的第一电离能 .

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数
(2)ⅦA族元素氢化物的沸点
(3)第三周期元素单质的熔点
(4)第三周期元素的最高正化合价
(5)IA族元素单质熔点
(6)F-、Na+、Mg2+、Al3+四种离子的离子半径
(7)部分短周期元素的原子半径
(8)短周期元素的第一电离能
考点:原子结构与元素的性质,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:(1)同一主族元素价电子数相等,与原子序数无关;
(2)ⅦA族元素氢化物的沸点随着原子序数增大而呈增大趋势,但HF沸点最高;
(3)第三周期元素单质的熔点随着原子序数增大先增大后减小;
(4)第三周期元素的最高正化合价随着原子序数增大而增大;
(5)IA族元素单质熔点随着原子序数增大而减小;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小;
(7)部分短周期元素的原子半径,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(8)短周期元素的第一电离能,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减小.
(2)ⅦA族元素氢化物的沸点随着原子序数增大而呈增大趋势,但HF沸点最高;
(3)第三周期元素单质的熔点随着原子序数增大先增大后减小;
(4)第三周期元素的最高正化合价随着原子序数增大而增大;
(5)IA族元素单质熔点随着原子序数增大而减小;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小;
(7)部分短周期元素的原子半径,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(8)短周期元素的第一电离能,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减小.
解答:
解:(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,故选B;
(2)ⅦA族元素氢化物的晶体都是分子晶体,与其相对分子质量成正比,所以VIIA氢化物的沸点随着原子序数增大而呈增大趋势,但HF中含有氢键导致沸点最高,故选D;
(3)第三周期元素单质晶体类型依次为:金属晶体、原子晶体、分子晶体,所以其单质的熔点随着原子序数增大先增大后减小,原子晶体Si熔点最高,故选E;
(4)第三周期元素的最高正化合价随着原子序数增大而增大,故选C;
(5)IA族元素单质中氢气是非金属单质,其余都是金属晶体,氢气单质的熔点最低,金属晶体的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,故选F;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小,F-、Na+、Mg2+、Al3+四种离子的离子半径依次减小,故选A;
(7)部分短周期元素的原子半径,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以其原子半径随着原子序数增大出现锯齿形结构,故选H;
(8)短周期元素的第一电离能,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减小,故选H.
(2)ⅦA族元素氢化物的晶体都是分子晶体,与其相对分子质量成正比,所以VIIA氢化物的沸点随着原子序数增大而呈增大趋势,但HF中含有氢键导致沸点最高,故选D;
(3)第三周期元素单质晶体类型依次为:金属晶体、原子晶体、分子晶体,所以其单质的熔点随着原子序数增大先增大后减小,原子晶体Si熔点最高,故选E;
(4)第三周期元素的最高正化合价随着原子序数增大而增大,故选C;
(5)IA族元素单质中氢气是非金属单质,其余都是金属晶体,氢气单质的熔点最低,金属晶体的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,故选F;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小,F-、Na+、Mg2+、Al3+四种离子的离子半径依次减小,故选A;
(7)部分短周期元素的原子半径,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以其原子半径随着原子序数增大出现锯齿形结构,故选H;
(8)短周期元素的第一电离能,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减小,故选H.
点评:本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,注意(5)中第IA族元素要考虑H元素,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法不正确的是( )
| A、需要加热才能发生的化学反应不一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定 |
| D、化学反应除了生成新的物质外,还伴随着能量的变化 |
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S
6Cu+SO2↑,对于该反应,下列说法正确的是.
| ||
| A、该反应的氧化剂只有Cu2O |
| B、Cu既是氧化产物又是还原产物 |
| C、每生成1 mol Cu,还原剂转移给氧化剂的电子为2mol |
| D、该反应中氧化产物与还原产物的质量比为1:6 |
下列元素中,属于第三周期的是( )
| A、氢 | B、碳 | C、磷 | D、氮 |
Fe(OH)3胶体与FeCl3溶液共同的性质是( )
| A、两者都有丁达尔效应 |
| B、Fe(OH)3胶体是红褐色沉淀 |
| C、两者都能透过滤纸 |
| D、都很稳定,其中Fe(OH)3胶体比FeCl3溶液更稳定 |
混合气体由O2和CH4组成,测得混合气体在标准状况下的密度为1.25g/L,则混合气体中O2和CH4的体积之比为( )
| A、3:1 | B、1:3 |
| C、4:1 | D、1:2 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温下,23g NO2和N2O4的混合气体含有NA个氧原子 |
| B、1L0.1mol?L-1的氨水含有0.1NA个OH- |
| C、标准状况下,22.4L CCl4含有个NA个CCl4分子 |
| D、含1molFe2+的酸性溶液与足量的H2O2溶液反应,转移2NA个电子 |
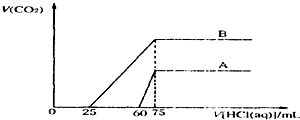 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.试回答下列间题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.试回答下列间题: