题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| B、25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| C、50mL 18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D、常温下,1L 0.1mol?L-1的NH4NO3溶液中氧原子数为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.乙烯和丙烯的最简式为CH2,根据二者的最简式计算出混合物中含有的氢原子数目;
B.缺少氢氧化钡溶液的体积,无法计算溶液中氢氧根离子的数目;
C.稀硫酸与铜不发生反应,生成二氧化硫的物质的量减少;
D.硝酸铵溶液中的溶剂为水,水中也含有氧原子.
B.缺少氢氧化钡溶液的体积,无法计算溶液中氢氧根离子的数目;
C.稀硫酸与铜不发生反应,生成二氧化硫的物质的量减少;
D.硝酸铵溶液中的溶剂为水,水中也含有氧原子.
解答:
解:A.7.0g乙烯和丙烯的混合物中含有0.5mol最简式CH2,含有1mol氢原子,含有氢原子的数目为NA,故A正确;
B.没有告诉氢氧化钡溶液的体积,无法计算溶液中氢氧根离子的物质的量及数目,故B错误;
C.50mL 18.4mol?L-1浓硫酸中含有0.92mol硫酸,消耗0.96mol硫酸能够生成0.46mol二氧化硫,由于随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以反应生成的二氧化硫小于0.46mol,生成SO2分子的数目小于0.46NA,故C错误;
D.1L 0.1mol?L-1的NH4NO3溶液中含有溶质硝酸铵0.1mol,0.1mol硝酸铵中含有0.3mol氧原子,由于溶剂水中含有氧原子,所以硝酸铵溶液中含有的氧原子大于0.3mol,含有的氧原子数大于0.3NA,故D错误;
故选A.
B.没有告诉氢氧化钡溶液的体积,无法计算溶液中氢氧根离子的物质的量及数目,故B错误;
C.50mL 18.4mol?L-1浓硫酸中含有0.92mol硫酸,消耗0.96mol硫酸能够生成0.46mol二氧化硫,由于随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以反应生成的二氧化硫小于0.46mol,生成SO2分子的数目小于0.46NA,故C错误;
D.1L 0.1mol?L-1的NH4NO3溶液中含有溶质硝酸铵0.1mol,0.1mol硝酸铵中含有0.3mol氧原子,由于溶剂水中含有氧原子,所以硝酸铵溶液中含有的氧原子大于0.3mol,含有的氧原子数大于0.3NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项BCD均为为易错点,B没有告诉溶液体积,C中稀硫酸与铜不反应,D中硝酸铵溶液中硝酸铵和水都含有氧原子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )


| A、若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa溶液,则D中溶液变浑浊 |
| B、若A为食盐水,B为电石,D中盛KMnO4酸性溶液,则D中溶液紫色褪去 |
| C、若A为浓氨水,B为生石灰,D中盛AgNO3溶液,则D中不会出现新的现象变化 |
| D、实验中仪器C可起到防止倒吸的作用 |
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
| A、H+、Ba2+、Mg2+、NO3- |
| B、Cl-、CO32-、Cu2+、Mg2+ |
| C、NO3-、SO42-、K+、OH- |
| D、NO3-、HCO3-、Ba2+、Cl- |
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍,下列说法正确的是( )| A、X的气态氢化物比Y的强 |
| B、Y的氧化物对应的水化物酸性比Z强 |
| C、W的非金属性比Z强 |
| D、X与Y形成的化合物都易溶于水 |
下列实验中,能够达到实验目的是( )
A、 实验室制取并收集氨气 |
B、 制取SO2并检验SO2的漂白性 |
C、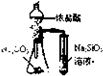 比较氯碳硅三种元素的非金属性强弱 |
D、 除去CO2中的HCl |
某混合溶液中只含有两种溶质NaCl和H2SO4,且n (NaCl):n(H2SO4)=3:1.若以石墨电极电解该溶液,下列推断中不正确的是( )
| A、阴极产物为H2 |
| B、阳极先析出Cl2,后析出O2 |
| C、电解液的pH不断增大,最终大于7 |
| D、整个电解的过程实质是电解水 |
 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题: