题目内容
2.某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+2H2O(g)?CO2(g)+4H2(g)反应,反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍.则①前4s以CH4浓度变化表示的平均反应速率为多少?
②4s时,混合气体中H2的体积分数为多少?
③平衡时,H2O(g)的浓度是多少?(要求:写出计算过程)
分析 反应进行到4s时CO2的浓度为0.08mol/L,生成CO2的物质的量为0.08mol/L×10L=0.8mol,则
CH4(g)+2H2O(g)?CO2(g)+4H2(g)
开始 2 3 0 0
转化 0.8 1.6 0.8 3.2
4s 1.2 2.4 0.8 3.2
以此解答①②;
设达到平衡时,转化的甲烷为xmol,则
CH4(g)+2H2O(g)?CO2(g)+4H2(g)
开始 2 3 0 0
转化 x 2x x 4x
平衡 2-x 3-2x x 4x
平衡时容器的压强是起始时的1.4倍,则$\frac{2-x+3-2x+x+4x}{2+3}$=1.4,解得x=1,以此解答③.
解答 解:反应进行到4s时CO2的浓度为0.08mol/L,生成CO2的物质的量为0.08mol/L×10L=0.8mol,则
CH4(g)+2H2O(g)?CO2(g)+4H2(g)
开始 2 3 0 0
转化 0.8 1.6 0.8 3.2
4s 1.2 2.4 0.8 3.2
①v(CH4)=$\frac{\frac{0.8mol}{10L}}{4s}$=0.02mol/(L•s),
答:前4s以CH4浓度变化表示的平均反应速率为0.02mol/(L•s);
②4s时,混合气体中H2的体积分数为$\frac{3.2mol}{1.2mol+1.4mol+0.8mol+3.2mol}$×100%=48.5%,
答:4s时,混合气体中H2的体积分数为48.5%;
③设达到平衡时,转化的甲烷为xmol,则
CH4(g)+2H2O(g)?CO2(g)+4H2(g)
开始 2 3 0 0
转化 x 2x x 4x
平衡 2-x 3-2x x 4x
平衡时容器的压强是起始时的1.4倍,则$\frac{2-x+3-2x+x+4x}{2+3}$=1.4,
解得x=1,平衡时,H2O(g)的浓度是$\frac{3mol-2×1mol}{10L}$=0.1mol/L,
答:平衡时,H2O(g)的浓度是0.1mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意4s时没有达到平衡,题目难度不大.

| A. | 32g O2 | B. | 0.2mol N2 | ||
| C. | 3.01×1023个CO2分子 | D. | 标准状况下11.2L H2O |
C(s)+H2O (g)?CO(g)+H2 (g),其化学平衡常数K和温度t的关系如表:
| t/(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)能判断该反应是否达到化学平衡状态的依据是abc.
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(H2)
(3)某温度下,平衡浓度符合下式:c(CO)•c(H2)=c(H2O),试判断此时的温度为830℃;在此温度下,若反应开始时H2O (g)的浓度为a mol/L,当反应达到平衡时测得CO与H2的浓度均为0.2mol/L,则反应开始时H2O的浓度a=0.24 mol/L.
| A. | 漂白粉被氧化了 | |
| B. | 有色布条被空气中的氧气氧化了 | |
| C. | 漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO | |
| D. | 漂白粉溶液蒸发掉部分水,其浓度增大 |
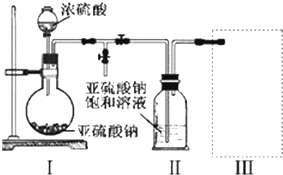

 (I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.
(I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.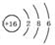 ,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为
,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为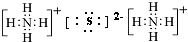 或
或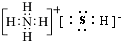 .
.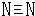
 如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题:
如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题: