题目内容
5.在标准状况下,4.48L的NH3气体物质的量为0.2mol质量为3.4g,其中含0.6NA个氢原子,将其溶于水配成200mL的溶液,其物质的量浓度为1mol/L.分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下4.48L氨气的物质的量,然后根据m=nM计算出氨气的质量;氨气分子中含有3个H原子,根据氨气的物质的量计算出含有H原子的物质的量;最后根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:标准状况下4.48L的NH3的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2 mol,质量为:m=nM=0.2 mol×17 g/mol=3.4 g;0.2mol氨气分子中含有H原子的物质的量为:0.2mol×3=0.6mol,含有氢原子数为0.6NA,
将0.2mol氨气溶于水配成200mL溶液,所得溶液的物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.2mol}{0.2L}$=1 mol/L.
故答案为:0.2;3.4;0.6NA;1.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数之间的关系为解答关键,试题有利于提高学生的化学计算能力.

练习册系列答案
相关题目
15.下列热化学方程式中的△H能表示物质燃烧热的是( )
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
16.七铝十二钙 (12CaO•7Al2O3)是一种新型的超导材料和发光材料,它是用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备.工业上制备AlC13溶液用图示流程(已知A1C13易升华).
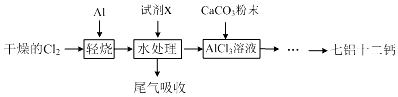
(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
补全实验步骤:向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤冰水洗涤,干燥,得到CaC12•2H2O.

(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
13.下列反应中,因反应物浓度改变,反应产物也会改变的是( )
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
20.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
①G→Q十NaCl
②Q+H2O$\stackrel{电解}{→}$X+H2
③Y十NaOH→G十Q十H2O
④Z十NaOH→Q十X十H2O
这五种化合物中氯的化合价由低到高的顺序为( )
①G→Q十NaCl
②Q+H2O$\stackrel{电解}{→}$X+H2
③Y十NaOH→G十Q十H2O
④Z十NaOH→Q十X十H2O
这五种化合物中氯的化合价由低到高的顺序为( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
10.下列叙述与胶体的性质无关的是( )
| A. | 江河入海口容易形成三角洲 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
17.胶体区别于其他分散系最本质的特征是( )
| A. | 外观澄清 | B. | 丁达尔效应 | ||
| C. | 胶体在一定条件下能稳定存在 | D. | 分散质粒子直径在1nm~100nm之间 |
14.下列说法正确的是( )
| A. | 电解法精炼铜是,以粗铜作阴极,精铜作阳极 | |
| B. | 加热0.1mol/L的Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 | |
| C. | 1L 1mol/L的NaClO溶液中含有ClO-的数目为6.02×1023 | |
| D. | 相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱 |
