题目内容
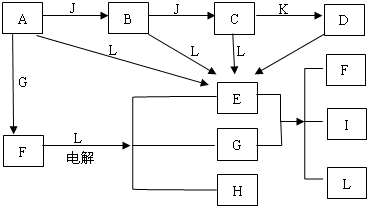
下列均为中学化学中常见的物质,E、G、J均为气体单质,其中G 为有色气体,L为液体,C的相对分子质量为78,图示电解反应是一个重要的工业生产过程.
根据上述信息回答下列问题:
(1)下列对C的结构、性质推断中不正确的是
A.久置于空气中会变成白色 B.具有强氧化性C.晶体中存在离子键和共价键 D.是一种碱性氧化物
(2)A原子结构示意图为 ,L的结构式为 .
(3)C和L反应生成E的反应中氧化剂与还原剂的物质的量之比为 .
(4)如果要利用上述物质中的某一种或者某几种制备A物质,可以用什么方法?试用化学方程式表述反应原理:
(5)I物质的水溶液可用于漂白消毒,但不能和SO2一起进行物质的漂白,试用离子方程式解释原理:
(6)在2mol/L 100mL E的水溶液中通入标况下3.36LK,所得溶液中离子浓度按从大到小顺序排列为: .

根据上述信息回答下列问题:
(1)下列对C的结构、性质推断中不正确的是
A.久置于空气中会变成白色 B.具有强氧化性C.晶体中存在离子键和共价键 D.是一种碱性氧化物
(2)A原子结构示意图为
(3)C和L反应生成E的反应中氧化剂与还原剂的物质的量之比为
(4)如果要利用上述物质中的某一种或者某几种制备A物质,可以用什么方法?试用化学方程式表述反应原理:
(5)I物质的水溶液可用于漂白消毒,但不能和SO2一起进行物质的漂白,试用离子方程式解释原理:
(6)在2mol/L 100mL E的水溶液中通入标况下3.36LK,所得溶液中离子浓度按从大到小顺序排列为:
考点:无机物的推断
专题:
分析:F在液体L中电解生成气体H和有色气体G,则L为H2O,G为Cl2,H为H2,F为活泼金属的盐酸盐,根据A+G→F,A+L→E,推断A为Na,则F为NaCl,E为NaOH,A能与J连续反应生成B和C,且C的相对分子质量为78,则C为Na2O2,B为Na2O,J为O2,E+G→F+I+L,则I为NaClO,C+K→D,D可以生成NaOH,可判断K可能为CO2,D可能为Na2CO3,利用A、B、C均能与水反应生成E验证以上推论正确,据此解答.
解答:
解:F在液体L中电解生成气体H和有色气体G,则L为H2O,G为Cl2,H为H2,F为活泼金属的盐酸盐,根据A+G→F,A+L→E,推断A为Na,则F为NaCl,E为NaOH,A能与J连续反应生成B和C,且C的相对分子质量为78,则C为Na2O2,B为Na2O,J为O2,E+G→F+I+L,则I为NaClO,C+K→D,D可以生成NaOH,可判断K可能为CO2,D可能为Na2CO3,利用A、B、C均能与水反应生成E验证以上推论正确,
(1)下列对Na2O2的结构、性质推断中
A.Na2O2久置于空气中最终形成Na2CO3粉末,会变成白色,故A正确;
B.Na2O2具有强氧化性,故B正确;
C.Na2O2晶体中钠离子与过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,故C正确;
D.Na2O2是一种过氧化物,不属于碱性氧化物,故D错误;
故答案为:D;
(2)Na原子结构示意图为 ,H2O的结构式为H-O-H,故答案为:
,H2O的结构式为H-O-H,故答案为: ;H-O-H;
;H-O-H;
(3)C和L反应生成E的反应为2Na2O2+2H2O=4NaOH+O2↑,既做氧化剂又做还原剂,氧化剂与还原剂的物质的量之比为中1:1,故答案为:1:1;
(4)若制备金属单质Na,由于Na的活泼性很强,不能利用热还原或置换生产,可以利用电解熔融氯化钠制备金属单质钠,反应方程式为2NaCl(熔融)
2Na+Cl2,故答案为:2NaCl(熔融)
2Na+Cl2;
(5)NaClO的水溶液可用于漂白消毒,但不能和SO2一起进行物质的漂白,因为NaClO具有强氧化性,SO2具有还原性,二者易发生反应ClO-+SO2+H2O=Cl-+SO42-+2H+,故答案为:ClO-+SO2+H2O=Cl-+SO42-+2H+;
(6)在2mol/L 100mL NaOH的水溶液中通入标况下3.36LCO2,形成的溶液为NaHCO3和Na2CO3的物质的量之比为1:1的混合溶液,由于NaHCO3、Na2CO3属于强碱弱酸盐,溶液显碱性,故混合溶液中离子浓度按从大到小顺序排列为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(1)下列对Na2O2的结构、性质推断中
A.Na2O2久置于空气中最终形成Na2CO3粉末,会变成白色,故A正确;
B.Na2O2具有强氧化性,故B正确;
C.Na2O2晶体中钠离子与过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,故C正确;
D.Na2O2是一种过氧化物,不属于碱性氧化物,故D错误;
故答案为:D;
(2)Na原子结构示意图为
 ,H2O的结构式为H-O-H,故答案为:
,H2O的结构式为H-O-H,故答案为: ;H-O-H;
;H-O-H;(3)C和L反应生成E的反应为2Na2O2+2H2O=4NaOH+O2↑,既做氧化剂又做还原剂,氧化剂与还原剂的物质的量之比为中1:1,故答案为:1:1;
(4)若制备金属单质Na,由于Na的活泼性很强,不能利用热还原或置换生产,可以利用电解熔融氯化钠制备金属单质钠,反应方程式为2NaCl(熔融)
| ||
| ||
(5)NaClO的水溶液可用于漂白消毒,但不能和SO2一起进行物质的漂白,因为NaClO具有强氧化性,SO2具有还原性,二者易发生反应ClO-+SO2+H2O=Cl-+SO42-+2H+,故答案为:ClO-+SO2+H2O=Cl-+SO42-+2H+;
(6)在2mol/L 100mL NaOH的水溶液中通入标况下3.36LCO2,形成的溶液为NaHCO3和Na2CO3的物质的量之比为1:1的混合溶液,由于NaHCO3、Na2CO3属于强碱弱酸盐,溶液显碱性,故混合溶液中离子浓度按从大到小顺序排列为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评:本题主要考查了Na单质及其化合物的性质的应用,侧重于学生的分析能力和理解能力的考查,难度较大,综合性很强.注意题干中“E、G、J均为气体单质”应改为“H、G、J均为气体单质”.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
工业上制造金刚砂(SiC)的化学方程式为:SiO2+3C
SiC+2CO↑,在这个氧化还原反应中,氧化剂与还原剂的物质的量之比为( )
| ||
| A、1:2 | B、2:1 |
| C、1:1 | D、3:5 |
下列离子方程式中正确的是( )
| A、氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2=HCO3- |
| B、亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+OH-=SO32-+H2O |
| C、氯气通入冷水中 Cl2+H2O=Cl-+ClO-+2H+ |
| D、碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
 中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)
中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)