题目内容
下列离子方程式表达正确的是( )
| A、向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| B、NaHSO3的水解:HSO3-+H2O?S032 -+H3O+ |
| C、四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| D、向小苏打溶液中加入少量Ba(OH)2:Ba2++HCO3-+OH -=BaCO3+H2O |
考点:离子方程式的书写
专题:
分析:A.二者发生氧化还原反应生成碘和水;
B.亚硫酸氢根离子水解生成亚硫酸和氢氧根离子;
C.发生氧化还原反应生成硝酸铁、NO、水;
D.二者反应生成碳酸钡、碳酸钠和水.
B.亚硫酸氢根离子水解生成亚硫酸和氢氧根离子;
C.发生氧化还原反应生成硝酸铁、NO、水;
D.二者反应生成碳酸钡、碳酸钠和水.
解答:
解:A.二者发生氧化还原反应生成碘和水,离子方程式为2I-+2H++H2O2=I2+2H2O,故A正确;
B.亚硫酸氢根离子水解生成亚硫酸和氢氧根离子,离子方程式为HSO3-+H2O?H2S03+OH-,故B错误;
C.发生氧化还原反应生成硝酸铁、NO、水,离子方程式为3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O,故C错误;
D.二者反应生成碳酸钡、碳酸钠和水,离子方程式为Ba2++2HCO3-+2OH-=BaCO3+2H2O+CO32-,故D错误;
故选A.
B.亚硫酸氢根离子水解生成亚硫酸和氢氧根离子,离子方程式为HSO3-+H2O?H2S03+OH-,故B错误;
C.发生氧化还原反应生成硝酸铁、NO、水,离子方程式为3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O,故C错误;
D.二者反应生成碳酸钡、碳酸钠和水,离子方程式为Ba2++2HCO3-+2OH-=BaCO3+2H2O+CO32-,故D错误;
故选A.
点评:本题考查离子方程式正误判断,明确离子性质及离子反应条件是解本题关键,单质、气体、沉淀、弱电解质、络合物、氧化物等写化学式,注意C中氧化物中的二价铁能被硝酸氧化生成三价,为易错点.

练习册系列答案
相关题目
工业上利用可逆反应 N2(g)+3H2(g)?2NH3(g)合成氨,下列叙述正确的是( )
| A、该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| B、恒温恒容下往平衡体系通入氩气,反应体系的压强会增大,反应速率也必定增大 |
| C、恒温恒压下往平衡体系通入氩气,反应体系的体积会增大,平衡体系朝逆向移动 |
| D、合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L0.1mol?L-1的氨水中有0.1NA个NH4+ |
| B、标准状况下,22.4L盐酸含有NA个HCl分子 |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为0.5NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.2NA |
下列相关反应的离子方程式书写正确的是( )
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、硫酸铜溶液显酸性:Cu2++2H2O═Cu(OH)2↓+2H+ |
| C、向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-=NH3↑+H2O |
| D、用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
某芳香族化合物A分子式为C10H10O3,已知苯环上只有两个取代基,A既能发生银镜反应,又能与饱和碳酸氢钠溶液反应放出二氧化碳气体,则满足上述条件的有机物A的种类有(不包括立体异构)( )
| A、9种 | B、12种 |
| C、15种 | D、18种 |
关于硝酸的叙述中不正确的是( )
| A、浓硝酸与浓盐酸一样,在空气中出现白雾 |
| B、硝酸见光分解和受热分解产物相同,都是NO2、O2和H2O |
| C、NO2与水反应有硝酸生成,所以NO2是硝酸酸酐 |
 合成
合成 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).
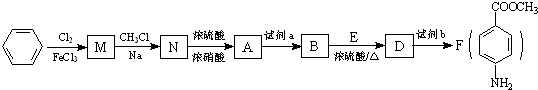
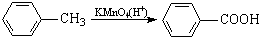


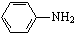 最多能够和
最多能够和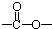 结构;
结构;