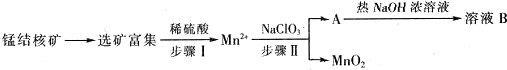题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L0.1mol?L-1的氨水中有0.1NA个NH4+ |
| B、标准状况下,22.4L盐酸含有NA个HCl分子 |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为0.5NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.一水合氨为弱电解质,部分电离;
B.气体摩尔体积适用于气体;
C.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子.
B.气体摩尔体积适用于气体;
C.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子.
解答:
解:A.1L0.1mol?L-1的氨水中含有一水合氨的物质的量为0.1mol,一水合氨为弱电解质,部分电离,所以电离出的铵根离子小于0.1NA个,故A错误;
B.标准状况下,盐酸为液体,不能适用气体摩尔体积,故B错误;
C.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故C错误;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故D正确;
故选:D.
B.标准状况下,盐酸为液体,不能适用气体摩尔体积,故B错误;
C.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故C错误;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故D正确;
故选:D.
点评:本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
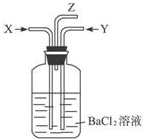
①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.

①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.
| A、①④ | B、①② | C、②③ | D、③④ |
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将20样品加热,其质量变为13.8g,则该样品的纯度(质量分数)是( )
| A、84% | B、16% |
| C、69% | D、31% |
下列有关化学用语使用正确的是( )
A、N2的电子式: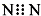 | ||
B、中子数为18的氯原子结构示意图: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3 ═Na++H++CO32- |
下列离子方程式表达正确的是( )
| A、向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| B、NaHSO3的水解:HSO3-+H2O?S032 -+H3O+ |
| C、四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| D、向小苏打溶液中加入少量Ba(OH)2:Ba2++HCO3-+OH -=BaCO3+H2O |
下列离子方程式书写正确的是( )
A、用电极电解少量的MgCl2溶液:2H2O+2Cl-
| ||||
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | ||||
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |