题目内容
在100mL稀硫酸和稀盐酸的混合溶液中加入3.42g氢氧化钡固体,充分反应后(若溶液体积不变),过滤、干燥得沉淀2.33g,经测定滤液pH=13.试求原混合溶液中硫酸和盐酸的物质的量浓度分别是多少?
考点:化学方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:充分反应后过滤得沉淀2.33g为硫酸钡的质量,经测定滤液pH=13,氢氧根有剩余,酸完全反应,根据n=
计算硫酸钡的物质的量,利用硫酸根守恒计算硫酸的量;利用n(H+)=n消耗(OH-)=2n[Ba(OH)2]-n剩余(OH-)计算原混酸溶液中氢离子物质的量,(HCl)=n(H+)-2n(H2SO4),再根据c=
计算硫酸、HCl的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:沉淀2.33g为硫酸钡的质量,则n(SO42-)=n(H2SO4)=n(BaSO4)=
=0.01mol,原混合液中c(H2SO4)=
=0.1mol/L;
反应后的溶液中c(OH-)=0.1mol/L,则Ba(OH)2的物质的量为
=0.02mol,则盐酸和硫酸中总的氢离子的物质的量:n(H+)=0.02mol×2-0.01mol=0.03mol,所以n(HCl)=0.03mol-2n(H2SO4)=0.03mol-2×0.01mol=0.01mol,所以原混合液中HCl的浓度为:
=0.1mol/L,
答:原混合溶液中硫酸、盐酸的物质的量浓度分别为0.1mol/L、0.1mol/L.
| 2.33g |
| 233g/mol |
| 0.01mol |
| 0.1L |
反应后的溶液中c(OH-)=0.1mol/L,则Ba(OH)2的物质的量为
| 3.42g |
| 171g/mol |
| 0.01mol |
| 0.1L |
答:原混合溶液中硫酸、盐酸的物质的量浓度分别为0.1mol/L、0.1mol/L.
点评:本题考查混合物计算、物质的量浓度计算,注意利用守恒法解答,避免方程式的繁琐,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、所有元素中钠的第一电离能最小 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、在所有元素中,氟的第一电离能和电负性值都是最大 |
| D、氮、氧、氟的原子半径小,电负性值大,与氢形成的共价键极性强,容易形成氢键 |
下列说法正确的是( )
| A、HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| D、NCl3分子中所有的原子均为8电子稳定结构 |
下列关于化学用语的表示正确的是( )
A、过氧化钠的电子式: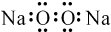 | ||
B、质子数为35、中子数为45的溴原子:
| ||
| C、氯化铵、次氯酸都属于强电解质 | ||
| D、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
| A、水银、硫酸、烧碱、硫酸氢钠 |
| B、碘酒、盐酸、烧碱、硫酸钡 |
| C、氧气、硝酸、纯碱、胆矾 |
| D、铁、醋酸、碱式碳酸铜、氯化铜 |
 现有部分前36号元素的性质或原子结构如下表:
现有部分前36号元素的性质或原子结构如下表: