题目内容
下列对实验现象的解释与结论正确的是( )
| A、除去SO2中少量HCl的方法是:将混合气体通过盛有NaHSO3饱和溶液的洗气瓶 |
| B、用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 |
| C、向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 |
| D、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
考点:化学实验方案的评价,硝酸的化学性质,二价Fe离子和三价Fe离子的检验
专题:实验评价题
分析:A.HCl可与NaHSO3饱和溶液反应生成SO2;
B.只能说明为挥发性酸;
C.向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,说明该无色溶液在酸性条件下具有强氧化性;
D.加入2滴KSCN溶液,溶液不显红色,说明不含Fe3+,再向溶液中加入几滴新制的氯水,溶液变为红色,说明生成Fe3+.
B.只能说明为挥发性酸;
C.向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,说明该无色溶液在酸性条件下具有强氧化性;
D.加入2滴KSCN溶液,溶液不显红色,说明不含Fe3+,再向溶液中加入几滴新制的氯水,溶液变为红色,说明生成Fe3+.
解答:
解:A.HCl可与NaHSO3饱和溶液反应生成SO2,而SO2不溶于NaHSO3饱和溶液,可用于除杂,故A正确;
B.只能说明为挥发性酸,不一定为盐酸,也可为硝酸,故B错误;
C.向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,说明该无色溶液在酸性条件下具有强氧化性,如硝酸盐等,故C错误;
D.加入2滴KSCN溶液,溶液不显红色,说明不含Fe3+,再向溶液中加入几滴新制的氯水,溶液变为红色,说明生成Fe3+,可说明含有Fe2+,故D正确.
故选AD.
B.只能说明为挥发性酸,不一定为盐酸,也可为硝酸,故B错误;
C.向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,说明该无色溶液在酸性条件下具有强氧化性,如硝酸盐等,故C错误;
D.加入2滴KSCN溶液,溶液不显红色,说明不含Fe3+,再向溶液中加入几滴新制的氯水,溶液变为红色,说明生成Fe3+,可说明含有Fe2+,故D正确.
故选AD.
点评:本题综合考查物质的分离、提纯以及检验等,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的可行性的评价,难度不大.

练习册系列答案
相关题目
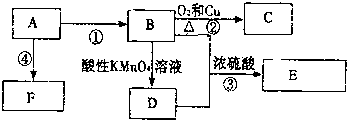

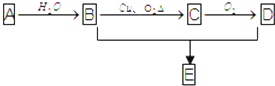
 已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题.
已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题.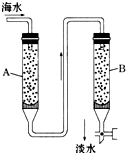 随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.
随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去. 如图所示是实验进行石油蒸馏的装置,请回答下列问题
如图所示是实验进行石油蒸馏的装置,请回答下列问题