题目内容
18. 已知25℃时,氢氟酸(HF)的电离平衡常数K=3.6×10-4,氢氰酸(HCN)的电离平衡常数K=4.9×10-10
已知25℃时,氢氟酸(HF)的电离平衡常数K=3.6×10-4,氢氰酸(HCN)的电离平衡常数K=4.9×10-10(1)某HF溶液的pH=2,则其由水电离出的c(H+)=10-12mol•L-1
(2)相同pH的HF溶液和HCN溶液,分别与相同体积、相同pH的NaOH溶液恰好完全中和,则消耗HF溶液的体积是大于(填“大于”或“小于”)消HCN溶液的体积
(3)0.4mol•L-1的HCN溶液和0.2mol•L-1的NaOH溶液等体积混合后溶液pH>7,则溶液中各离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+)
(4)常温下,将0.1mol•L-1的HF溶液加水稀释的过程中,下列表达式的数值会变大的是BD
A.c(H+) B.$\frac{c({H}^{+})}{c(HF)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(5)常温下,体积为10mL pH=2的HCN溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图.则HX在稀释过程中,其电离平衡常数不变(填“变大”“不变”或“变小”),理由是电离平衡常数只与温度有关,温度不变电离平衡常数不变;
(6)稀释后,HX溶液中由水电离出的c(H+)大于(填“大于”“小于”或“等于”)HCN溶液中水电离出的c(H+)
分析 (1)某HF溶液的pH=2,则其由水电离出的c(H+)=c(OH-)=$\frac{{K}_{w}}{1{0}^{-pH}}$;
(2)酸的电离平衡常数HF>HCN,则酸性HF>HCN,相同pH的HF溶液和HCN溶液,c(HF)<c(HCN),等pH的这两种酸,分别与相同体积、相同pH的NaOH溶液恰好完全中和,消耗酸的体积其物质的量浓度成反比;
(3)0.4mol•L-1的HCN溶液和0.2mol•L-1的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的HCN、NaCN,混合溶液pH>7,说明HCN电离程度小于CN-水解程度,结合电荷守恒判断离子浓度大小;
(4)常温下,将0.1mol•L-1的HF溶液加水稀释的过程中,促进HF电离,但HF电离增大程度小于溶液体积增大程度,所以c(H+)减小,温度不变水的离子积常数不变,则c(OH-)增大;
(5)电离平衡常数只与温度有关;
(6)酸或碱抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大.
解答 解:(1)某HF溶液的pH=2,则其由水电离出的c(H+)=c(OH-)=$\frac{{K}_{w}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-2}}$mol/L=10-12 mol/L,故答案为:10-12;
(2)酸的电离平衡常数HF>HCN,则酸性HF>HCN,相同pH的HF溶液和HCN溶液,c(HF)<c(HCN),等pH的这两种酸,分别与相同体积、相同pH的NaOH溶液恰好完全中和,消耗酸的体积其物质的量浓度成反比,所以消耗V(HF)大于V(HCN),故答案为:大于;
(3)0.4mol•L-1的HCN溶液和0.2mol•L-1的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的HCN、NaCN,混合溶液pH>7,则c(H+)<c(OH-),说明HCN电离程度小于CN-水解程度,结合电荷守恒得c(Na+)>c(CN-),所以离子浓度大小顺序是c(Na+)>c(CN-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+),
(4)常温下,将0.1mol•L-1的HF溶液加水稀释的过程中,促进HF电离,但HF电离增大程度小于溶液体积增大程度,所以c(H+)减小,温度不变水的离子积常数不变,则c(OH-)增大,
A.根据以上分析知,随着稀释溶液中c(H+)减小,故错误;
B.加水稀释促进HF电离,所以n(HF)减小、n(H+)增大,所以$\frac{c({H}^{+})}{c(HF)}$增大,故正确;
C.温度不变,水的离子积常数不变,所以c(H+)•c(OH-)不变,故错误;
D.溶液中c(H+)减小,温度不变水的离子积常数不变,c(OH-)增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故正确;
故选BD;
(5)电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故答案为:不变;电离平衡常数只与温度有关,温度不变电离平衡常数不变;
(6)酸或碱抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大,稀释后c(H+)HCN>HX,所以HX溶液中由水电离出的c(H+)大于HCN溶液中水电离出的c(H+),故答案为:大于.
点评 本题考查弱电解质的电离,为高频考点,明确弱酸电离平衡常数与其酸性强弱关系是解本题关键,注意:电离平衡常数只与温度有关,与溶液酸碱性强弱、溶液浓度无关,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | ①②③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |

其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)Na2SO3+H2O2=Na2SO4+H2O.
H2O2可以看作是一种很弱的酸,写出其电离方程式:H2O2?H++HO2-.
(3)该黄铁矿石中硫元素的质量分数为$\frac{32m{\;}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
| A. | HCl(H2S) | B. | O2(N2) | C. | CO(H2S) | D. | H2S(HCl) |
| A. | Ba(OH)2、Na2S03、FeCl3、KCl | B. | Na2Si03、Na2C03、KN03、NH4Cl | ||
| C. | NH3、H20、H3P04、Na2S04、H2S04 | D. | HCl、CH2COOH、C2H5OH、Na2SiO3 |
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
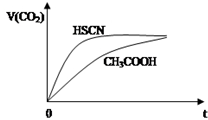
(2)25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快.反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
