题目内容
在A、B两烧杯溶液中,含有Fe2+、Na+、H+、NO3-、Cl-、OH-6种离子.已知B烧杯的溶液无色(含有其中三种离子),则A烧杯的溶液中大量存在的离子是( )
| A、NO3-、OH-、Cl- |
| B、Fe2+、H+、Cl- |
| C、Fe2+、OH-、NO3- |
| D、Na+、H+、OH- |
考点:离子共存问题
专题:离子反应专题
分析:B烧杯的溶液无色,则A烧杯的溶液一定有Fe2+,Fe2+、OH-反应,则B中存在OH-,且OH-与H+反应生成水,则H+存在A中,又Fe2+、H+、NO3-发生氧化还原反应而不能共存,则NO3-在B中,结合溶液为电中性来解答.
解答:
解:B烧杯的溶液无色,则A烧杯的溶液一定有Fe2+,Fe2+、OH-反应,则B中存在OH-,且OH-与H+反应生成水,则H+存在A中,又Fe2+、H+、NO3-发生氧化还原反应而不能共存,则NO3-在B中,又溶液为电中性,B中一定存在阳离子为Na+,所以A中存在Cl-,
故选B.
故选B.
点评:本题考查离子的共存,为高频考点,注意发生的氧化还原反应为解答的难点,并结合溶液为电中性来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液终点时仰视读数,氢氧化钠浓度偏低 |
| B、pH=13的溶液中:CO32-、Na+、AlO2-、NO3- 能大量共存 |
| C、向500mL 1 mol/L Na2CO3溶液中,滴加600mL 1 mol/L HCl得到标况下CO2体积为11.2L |
| D、用丁达尔现象可鉴别蛋白质溶液、淀粉溶液和葡萄糖溶液 |
分别将一小块钠投入下列溶液中,只有一种气体放出,没有沉淀生成的是( )
| A、饱和NaCl溶液 |
| B、稀NaHSO4溶液 |
| C、MgCl2溶液 |
| D、CuSO4溶液 |
下列现象或事实可用同一化学原理解释的是( )
| A、氯气和二氧化硫使品红溶液褪色 |
| B、常温下,可以用铝制容器贮藏浓硫酸和浓硝酸 |
| C、浓硫酸和浓盐酸暴露在空气中浓度均减小 |
| D、氯化铵和碘都可以用加热法进行提纯 |
在无色透明溶液中,下列各离子组能大量共存的是( )
| A、SO42- Na+Fe3+ Cl- |
| B、Ba2+ Na+Cl- SO42- |
| C、HCO3-K+ SO42-OH- |
| D、Ag+ Al3+ NO3-H+ |
对于可逆反应H2(g)+I2(g)?2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、正、逆反应速率的比值是恒定的 |
| C、当HI的分子数与I2分子数之比为2:1时,说明反应达到了平衡状态 |
| D、达到平衡时,正、逆反应速率相等 |
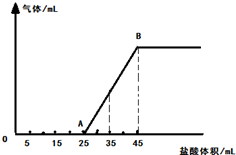 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示: