题目内容
欲测定烟雾中的SO2含量,可做下列实验:取100L该空气(标准状况),通过盛放100mL过氧化氢(H2O2)水溶液的吸收瓶,使烟雾中的SO2完全吸收,生成硫酸.在反应后的水溶液中加入足量BaCl2溶液,生成白色沉淀,经测定其质量为11.65g(烟雾中其他成分对测定结果无影响).
(1)写出SO2和H2O2反应的离子方程式.
(2)写出H2SO4与BaCl2反应的离子方程式.
(3)求100L空气中SO2的体积分数.
(1)写出SO2和H2O2反应的离子方程式.
(2)写出H2SO4与BaCl2反应的离子方程式.
(3)求100L空气中SO2的体积分数.
考点:探究物质的组成或测量物质的含量,二氧化硫的化学性质
专题:氧族元素
分析:(1)SO2具有还原性,双氧水具有氧化性,二者发生氧化还原反应生成硫酸;
(2)稀硫酸和氯化钡反应生成硫酸钡白色沉淀硫酸钡;
(3)硫酸钡的质量是11.65g,物质的量是
=0.05mol
因此根据S原子守恒可知,SO2的物质的量也是0.05mol
则100 L空气中SO2的体积分数是
×100%=1.12%.
(2)稀硫酸和氯化钡反应生成硫酸钡白色沉淀硫酸钡;
(3)硫酸钡的质量是11.65g,物质的量是
| 11.65g |
| 233g/mol |
因此根据S原子守恒可知,SO2的物质的量也是0.05mol
则100 L空气中SO2的体积分数是
| 0.05mol×22.4lL/mol |
| 100L |
解答:
解:(1)SO2具有还原性,双氧水具有氧化性,二者发生氧化还原反应,反应的离子方程式是SO2+H2O2=2H++SO42-;
答:SO2和H2O2反应的离子方程式为:SO2+H2O2=2H++SO42-;
(2)稀硫酸和氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式是:SO42-+Ba2+=BaSO4↓;
答:H2SO4与BaCl2反应的离子方程式:SO42-+Ba2+=BaSO4↓;
(3)硫酸钡的质量是11.65g,物质的量是
=0.05mol
因此根据S原子守恒可知,SO2的物质的量也是0.05mol
则100 L空气中SO2的体积分数是
×100%=1.12%;
答:100L空气中SO2的体积分数为1.12%.
答:SO2和H2O2反应的离子方程式为:SO2+H2O2=2H++SO42-;
(2)稀硫酸和氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式是:SO42-+Ba2+=BaSO4↓;
答:H2SO4与BaCl2反应的离子方程式:SO42-+Ba2+=BaSO4↓;
(3)硫酸钡的质量是11.65g,物质的量是
| 11.65g |
| 233g/mol |
因此根据S原子守恒可知,SO2的物质的量也是0.05mol
则100 L空气中SO2的体积分数是
| 0.05mol×22.4lL/mol |
| 100L |
答:100L空气中SO2的体积分数为1.12%.
点评:本题是基础性试题的考查,难度不大,侧重对学生基础知识的巩固,有利于培养学生的逻辑思维能力和规范答题能力.该题的关键是利用好原子守恒,守恒法是化学计算中最常用的方法,需要在平时的学习中注意积累和总结、归纳.

练习册系列答案
相关题目
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;Z2-离子半径大于W-离子半径;Y是一种重要的半导体材料.下列说法中错误的是( )
| A、元素X、M可形成既含离子键又含共价键的化合物 |
| B、气态氢化物的稳定性:Z<W |
| C、Y元素在自然界中以化合物的形式存在 |
| D、W元素的含氧酸都属于强酸 |
已知酸性强弱顺序为H2CO3> >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )
 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )A、 |
B、 |
C、 |
D、 |
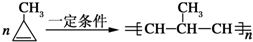 ;
; .
.
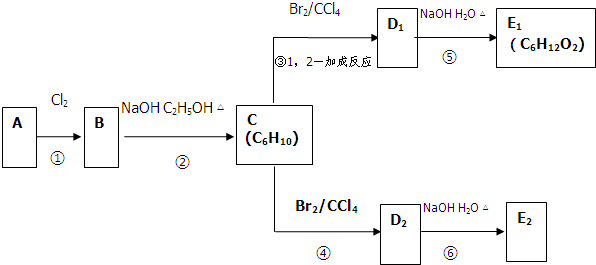

 如图所示,A、B、C、D、E五种物质的相互转化关系
如图所示,A、B、C、D、E五种物质的相互转化关系